题目内容
2.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| B. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| C. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |
分析 A、标况下2.24L氯气的物质的量为0.1mol,而氯气与碱的反应为歧化反应;
B、反应后钠元素为+1价;
C、将氯化钠溶于1L水后,溶液的体积大于1L;
D、标况下三氧化硫为固体.
解答 解:A、标况下2.24L氯气的物质的量为0.1mol,而氯气与碱的反应为歧化反应,1mol氯气转移1mol电子,故0.1mol氯气转移0.1mol电子即0.1NA个,故A错误;
B、反应后钠元素为+1价,故1mol钠失去1mol电子即NA个,故B正确;
C、将氯化钠溶于1L水后,溶液的体积大于1L,故溶液的浓度小于1mol/L,故C错误;
D、标况下三氧化硫为固体,故0.1NA个三氧化硫的体积小于2.24L,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.NA表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 标准状况下,11.2 L H2O所含的电子数为5NA | |
| B. | 0.1molFe原子变成 Fe3+时失去的电子数为O.3NA | |
| C. | 常温常压下,16gO2与16gO3含有的分子数为相同 | |
| D. | 0.1mol/LK2SO4溶液中含有K+数目为0.2NA |
7.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法表示更便于理解.下列表达正确的是( )
| A. | Na2CO3溶液和盐酸反应后溶液中的钠盐: | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: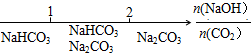 | |
| C. | Fe与稀硝酸反应的氧化产物: | |
| D. | AlCl3溶液中滴加氨水后铝元素的存在形式: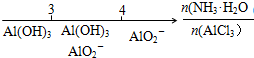 |
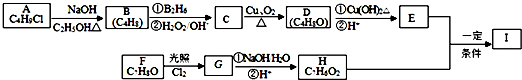
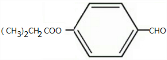 ;
;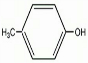 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$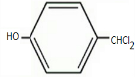 +2HCl;
+2HCl;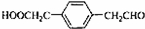 .
.