题目内容
1.如图为元素周期表前四周期的一部分,且 X、Y、Z、R 和 W 为主族元素.下列说法正确的是( )| X | |||
| Y | Z | R | |
| W |
| A. | 五种元素的原子最外层电子数一定都大于 2 | |
| B. | Y 单质一定既能与盐酸又能与氢氧化钠溶液反应 | |
| C. | R 的最高价氧化物对应的水化物一定是强酸 | |
| D. | 若 Z 位于第ⅣA 族,则 Z 的氧化物与 Y 的氧化物中化学键类型相同 |
分析 图为元索周期表前四周期的一部分,且X、Y、Z、R和W为主族元素,长周期中ⅡA、ⅢA族不相邻,故Y可能是ⅢA族或ⅣA族元素,当Y位于ⅢA族时,只能是Al元素,X、Z是ⅣA族的C、Si,R是ⅤA族的P,W为Se元素;当Y位于ⅣA族时,Y为Si元素,X为N元素,Z为P元素,R为S元素,W为Br元素,根据元素所在周期表中的位置结合周期律的递变规律解答该题.
解答 解:图为元索周期表前四周期的一部分,且X、Y、Z、R和W为主族元素,长周期中ⅡA、ⅢA族不相邻,故Y可能是ⅢA族或ⅣA族元素,当Y位于ⅢA族时,只能是Al元素,X、Z是ⅣA的C、Si,R是ⅤA族的P,W为Se元素;当Y位于ⅣA族时,Y为Si元素,X为N元素,Z为P元素,R为S元素,W为Br元素,
A.Y可能是ⅢA族或ⅣA族元素,则五种元素的原子最外层电子数一定都大于2,故A正确;
B.当Y是Al元素时,既能和盐酸又能和氢氧化钠溶液反应,当Y是Si元素时,硅能和氢氧化钠溶液反应但不和盐酸反应,故B错误;
C.R可能是P或S元素,磷酸是中强酸,故C错误;
D.若 Z 位于第ⅣA 族,则Z为Si,Y为Al,它们的氧化物分别为二氧化硅、氧化铝,二氧化硅含有共价键,氧化铝含有离子键,故D错误,
故选A.
点评 本题考查位置结构性质的相互关系应用,难度中等,正确推断元素所在周期表中的位置是关键,注意短周期与长周期中ⅡA、ⅢA族位置.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
11.在下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 0.5L0.1mol/L的NaCl溶液 | B. | 1L0.2mol/L的MgCl2溶液 | ||
| C. | 1L0.3mol/L盐酸溶液 | D. | 100mL0.2mol/L的AlCl3溶液 |
9.下列污水处理的方法、目的和离子方程式及其对应关系均正确的是( )
| 方法 | 目的 | 离子方程式 | |
| A | 中和法 | 用H2SO4中和碱性废水 | H++OH-═H2O |
| B | 混凝法 | 除去水中悬浮物 | Al3++H2O═Al(OH)3↓+H+ |
| C | 沉淀法 | 除去废水中的Hg2+ | Hg2++Na2S═HgS↓+Na+ |
| D | 氧化法 | 消毒 | Cl2+2OH-═Cl-+ClO-+H2O |
| A. | A | B. | B | C. | C | D. | D |
16.下列装置或操作不能达到实验目的是( )
| A. | 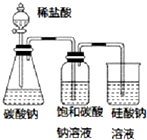 图中的实验现象能证明非金属性:Cl>C>Si | |
| B. | 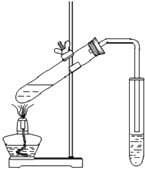 图可用于实验室制备并收集乙酸乙酯 | |
| C. |  图中,气体从a口进入时,可用于收集H2、CH4、NH3等气体 | |
| D. | 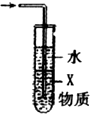 图中X若为CCl4,可用于吸收NH3或HCl |
10.下列说法正确的是( )
| A. | 等质量的N2和C2H4体积一定相等 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
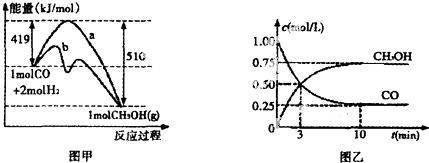
 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: