题目内容
6.近年来,碳和碳的化合物在生产生活实际中应用越来越广泛.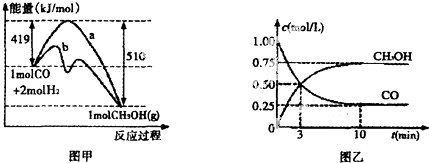
(1)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气.已知某反应的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,它所对应的化学方程式为:C(s)+H2O(g)?CO(g)+H2(g).
(2)甲醇是一种重要的化工原料,在日常生活中有着广泛的应用.工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因是反应Ⅰ符合“原子经济性”的原则即原子利用率为100%.
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.在“图甲”中,曲线b(填:“a”或“b”)表示使用了催化剂;该反应属于放热(填:“吸热”、“放热”)反应.在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率0.15mol/L•min.
③对于反应Ⅱ,在一定温度时,将lmol CO2 和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为1-$\frac{a}{2}$;若容器容积不变,下列措施可增加甲醇产量的是bd.
a.升高温度 b.增加CO2的量
c.充入He,使体系总压强增大 d.按原比例再充入CO2和H2.
分析 (1)化学平衡常数指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,根据元素守恒,故另一反应物为固体C,据此书写方程式;
(2)①比较反应Ⅰ和Ⅱ,从反应物是否完全转化比较二者的优劣;
②根据图象的变化趋势判断反应进行的方向和影响因素,依据物质能量变化分析反应热量变化;图2分析计算一氧化碳的反应速率,依据反应速率之比等于化学计量数之比计算氢气表示的反应速率;依据化学平衡三段式列式计算平衡浓度,依据平衡常数概念计算平衡常数;
③依据化学平衡三段式列式计算,平衡气体物质的量和起始压强之比等于气体物质的量之比计算得到;增加甲醇产率,应使平衡正向进行.
解答 解:(1)平衡表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为:C(s)+H2O(g)?CO(g)+H2(g),
故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)①反应I中反应物完全转化,原子利用率为100%,符合“原子经济性”的原则,
故答案为:反应Ⅰ符合“原子经济性”的原则即原子利用率为100%;
②分析图1可知反应能量变化b图象是使用催化剂降低反应的活化能,加快反应速率;图象分析反应物能量高于生成物的能量,反应是放热反应;图2分析计算一氧化碳的反应速率v(CO)=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/L•min,由反应速率之比等于化学计量数之比可知,氢气表示的反应速率为v(H2)=2v(CO)=0.075mol/L•min×2=0.15mol/L•min,故答案为:b;放热;0.15mol/L•min;
③对于反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在一定温度时,将1mol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) a 3a a a
平衡量(mol) 1-a 3-3a a a
则容器内的平衡压强与起始压强之比=(1-a+3-3a+a+a):(1+3)=1-$\frac{a}{2}$;
a.由①可知,该反应放热,升温,平衡向逆反应方向移动,甲醇产率减小,故错误;
b.增加CO2的量,平衡向正反应方向移动,甲醇产率增大,故正确;
c.充入He,使体系总压强增大,各物质的浓度不变,平衡不移动,故错误
d.按原比例再充入CO2和H2,由等效平衡可知平衡正向移动,甲醇产率增大,故正确;
故答案为:1-$\frac{a}{2}$;bd.
点评 本题考查了化学平衡的分析应用,化学反应速率、平衡常数计算应用,题目难度中等.

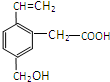 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是①能使酸性KMnO4溶液褪色;②可以燃烧;
③能发生水解反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能跟NaOH溶液反应( )
| A. | ①④ | B. | 只有⑥ | C. | 只有③ | D. | ④⑥ |
| X | |||
| Y | Z | R | |
| W |
| A. | 五种元素的原子最外层电子数一定都大于 2 | |
| B. | Y 单质一定既能与盐酸又能与氢氧化钠溶液反应 | |
| C. | R 的最高价氧化物对应的水化物一定是强酸 | |
| D. | 若 Z 位于第ⅣA 族,则 Z 的氧化物与 Y 的氧化物中化学键类型相同 |
| A. | 相同 | B. | 中和HCl的多 | C. | 中和CH3COOH的多 | D. | 无法比较 |
| A. | 1mol Na2O2固体中含有的阴离子数为2NA | |
| B. | 常温常压下,3.2g CH4中含有的电子数为2NA | |
| C. | 标准状况下,11.2L乙酸乙酯中含有的分子数为0.5NA | |
| D. | 100mL 1mol•L-1 CH3COOH溶液中含有的CH3COOH分子数为0.1NA |
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L乙烷中含有的极性键数目为0.6NA | |
| C. | 室温下,3g甲醛和乙酸的混合物中含有的原子数目为0.8NA | |
| D. | 56g铁与足量稀硫酸反应转移的电子数为3NA |
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置. (1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3
(1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3