题目内容
7.为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )| A. | 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 | |
| B. | 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 | |
| C. | 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 | |
| D. | 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
分析 A、金属镁的活泼性强于金属铝,外界条件相同时,镁和盐酸反应的速率更快;
B、根据催化剂、温度对化学反应速率的影响判断;
C、根据温度对化学反应速率的影响判断;
D、升高温度,活化分子的百分数增加,反应速率增大,据此回答.
解答 解:A、将大小、形状相同的镁条和铝条与同浓度、同温度下的盐酸反应时,镁条反应的快,故A错误;
B、在其它条件相同的情况下,温度、催化剂影响化学反应速率,温度越高且加入催化剂,化学反应速率越快,故B正确;
C、条件相同的情况下,温度影响化学反应速率,温度越高,化学反应速率越大,故C正确;
D、升高温度后H2O2的分解速率加快,原因是升高温度,活化分子的百分数增加,有效碰撞次数增加,反应速率增大,故D正确.
故选A.
点评 决定化学反应速率大小的主要因素是物质本身的性质,外界条件是次要因素.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
18.以下物质间的每步转化,存在不能通过一步反应实现的是( )
| A. | SO2→SO3→H2SO4→MgSO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | Na→NaCl→NaOH→Na2CO3 |
2.如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置.则下列说法正确的是( )
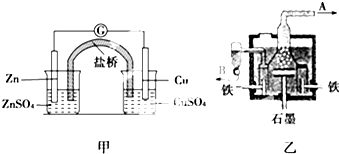

| A. | 甲装置中锌为负极,发生氧化反应,SO42-向铜极移动 | |
| B. | 乙装置中B是氯气出口,A是钠出口 | |
| C. | 乙装置中铁极为阳极,石墨为阴极 | |
| D. | 甲装置中的反应是自发反应,有化学能转化为电能;乙装置中的反应是非自发反应,有电能转化为化学能 |
12.下列说法正确的是( )
| A. | 浓硫酸能使蔗糖变黑,体现浓硫酸具有强酸化性 | |
| B. | 铵盐受热易分解,均有NH3产生 | |
| C. | 闪电时,N2转化为NO可以称为氮的固定 | |
| D. | 化工厂可通过加高烟囱排放废气,防止形成酸雨 |
19.在标准状况下,在一个容积为V L的圆底烧瓶中收集满氨气,配上塞子、导管等进行喷泉实验,烧瓶中溶液的物质的量浓度为( )
| A. | 1/22.4mol/L | B. | V/33.6mol/L | C. | V/22.4mol/L | D. | 1/33.6mol/L |
16.下列关于元素周期表的说法正确的是( )
| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 过渡元素全部是金属元素,因此它们又被称为过渡金属 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
1.某实验室小组偶然发现将镁条插入饱和NaHCO3溶液中,镁条表面出现大量气泡.为了探究产生此现象的原因,该小组设计实验探究如下:
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
(3)对于反应中产生的气体(不考虑水蒸气),请你完成假设二和假设三:假设一:只有CO2;假设二:只有H2;假设三:H2和CO2;
请假设实验,用镁条和饱和NaHCO3溶液制取气体并检验其中是否含有CO2,写出实验步骤和结论.
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 将镁条投入5mL蒸馏水 | 微量气泡 | Mg与蒸馏水缓慢反应 |
| ② | 将镁条投入5mL饱和NaHCO3溶液中 | 镁表面出现大量气泡 | Mg与NaHCO3溶液剧烈反应 |
| ③ | 将镁条投入5mLNaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
请假设实验,用镁条和饱和NaHCO3溶液制取气体并检验其中是否含有CO2,写出实验步骤和结论.
| 实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 |

 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
 ,④的反应类型取代反应(或水解反应).
,④的反应类型取代反应(或水解反应). .
.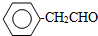 或
或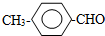 .
. (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)