题目内容
【题目】(1)将Cl2通入水中,Cl2部分与水反应:Cl2+H2![]() OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
A.AgNO3晶体 B.CaCO3粉末 C.NaCl晶体 D.蒸馏水 E.浓盐酸
(2)在一定条件下,同时加入CO、H2O(g)、CO2、H2于一密闭容器中发生如下反应:CO+H2O(g)![]() CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
A.反应开始时,正反应速率大于逆反应速率
B.反应开始时,正反应速率最大,逆反应速率为零
C.随着反应的进行,正反应速率逐渐减小,最后为零
D.随着反应的进行,逆反应速率增大,正反应速率减小,最后相等
(3)一定条件下(温度恒定),SO2与O2反应的浓度随时间的变化如下表。
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)/(mol·L-1) | 1.0 | |||||||
c(O2)/(mol·L-1) | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
c(SO3)/(mol·L-1) | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表数据计算:
A.30~40min时间段,以SO2表示的反应速率为___;
B.该温度下,正反应的平衡常数的值为___;
C.平衡时,SO2的转化率为___。
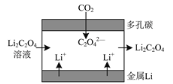
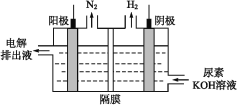
(4)电解尿素的碱性溶液制氢气的装置示意图见如图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为___。
(5)3.04g铜镁合金完全溶解于100mL密度为1.40g·cm-3、质量分数为63%的硝酸中,得到NO2气体2688mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则加入NaOH溶液的体积是___mL。
【答案】CE BC 0.015mol·L-1·min-1 1620 90%(或0.9) CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O 1280
【解析】
(1)根据影响平衡移动的因素进行分析作答;
(2)根据影响化学平衡状态的建立因素进行分析作答;
(3) 根据化学反应速率和化学平衡的公式进行直接计算;
(4)考查电极反应式的书写,环境是碱性,根据电解示意图,阳极得到N2,因此是CO(NH2)2在阳极上放电;
(5)考查化学计算,当金属离子全部转化成沉淀时,溶液中的溶质为NaNO3,根据元素守恒有,可得答案。
(1) A. 加入硝酸银晶体,AgNO3与Cl-反应生成氯化银沉淀,平衡右移,A项错误;
B. 加入碳酸钙固体,与氢离子反应,平衡右移,B项错误;
C. 加入NaCl晶体,增加氯离子浓度,平衡左移,抑制氯气的溶解,C项正确;
D. 加水稀释,促进氯气的溶解,D项错误;
E. 加入浓盐酸,氯离子浓度增大,平衡向逆反应方向移动,抑制氯气的溶解,E项正确;
故答案为:CE;
(2) A. 反应开始时,因为反应向右进行,因此正反应速率大于逆反应速率,A项正确;
B. 因为同时加入CO、H2O(g)、CO2、H2,且此反应是可逆反应,因此正逆反应同时进行,开始时向右进行,正反应速率最大,逆反应速率最小,但不等于0,只不过正反应方向速率大于逆反应方向速率,B项错误;
C. 随着反应的进行,正反应速率逐渐减小,当正、逆反应速率相等,化学平衡建立,但正反应速率不等于0,C项错误;
D. 随着反应进行,正反应速率减小,逆反应速率增大,当两者相等时,化学平衡建立,D项正确;
故答案为:BC;
(3) A.v(SO3)=![]() mol·L-1·min-1=0.015mol·L-1·min-1,根据化学反应速率之比等于化学计量数之比,因此v(SO2)=v(SO3)=0.015mol·L-1·min-1,故答案为:0.015mol·L-1·min-1;
mol·L-1·min-1=0.015mol·L-1·min-1,根据化学反应速率之比等于化学计量数之比,因此v(SO2)=v(SO3)=0.015mol·L-1·min-1,故答案为:0.015mol·L-1·min-1;
B. 达到化学平衡时c(SO2)=![]() mol·L-1=0.1mol·L-1,根据化学平衡常数的表达式,K=
mol·L-1=0.1mol·L-1,根据化学平衡常数的表达式,K=![]() =1620,故答案为1620;
=1620,故答案为1620;
C. SO2的转化率为α(SO2)=![]() ×100%=90%,故答案为:90%(或0.9);
×100%=90%,故答案为:90%(或0.9);
(4)根据电解示意图,阳极得到N2,因此是CO(NH2)2在阳极上放电,因此电极反应式为CO(NH2)2+8OH--6e-=C![]() +N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(5)当金属离子全部转化成沉淀时,溶液中的溶质为NaNO3,根据元素守恒有,n(NaOH)=n(NaNO3)=n(HNO3)-n(NO2)=![]() =1.28mol,因此需要的氢氧化钠溶液的体积为
=1.28mol,因此需要的氢氧化钠溶液的体积为![]() ×103mL·L-1=1280mL,故答案为:1280。
×103mL·L-1=1280mL,故答案为:1280。

 考前必练系列答案
考前必练系列答案【题目】Mn(H2PO4)2·2H2O是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备Mn(H2PO4)2·2H2O的流程如图:
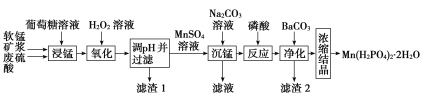
(1)软锰矿要先制成矿浆的目的是__,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为:__。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表,“调pH并过滤”时,应调整的pH范围为__,滤渣1的主要成分为__(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为__。
(5)某工厂用上述流程制备Mn(H2PO4)2·2H2O,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1吨该软锰矿可制得Mn(H2PO4)2·2H2O__t。