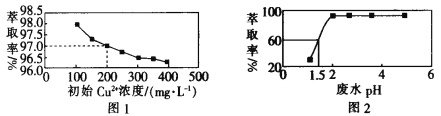
题目内容
【题目】据媒体报道,法国一家公司 Tiamat 日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从 2020 年开始实现工业生产。该电池的负极材料为 Na2Co2TeO6(制备原料为 Na2CO3、Co3O4和TeO2),电解液为 NaClO4 的碳酸丙烯酯溶液。 回答下列问题:
(1)Te 属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态 Na 原子中,核外电子占据的原子轨道总数为______,最高能层电子云轮廓图形状为______。
(3)结合题中信息判断:C、O、Cl 的电负性由大到小的顺序为______ (用元素符号表示)。
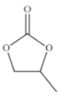
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为______,1mol 碳酸丙烯酯中σ键的数目为______。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是______,该配离子包含的作用力为______ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
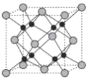
(6)Na 和 O 形成的离子化合物的晶胞结构如图所示,晶胞中 O 的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为 NA,则Na与O之间的最短距离为______cm(用 ρ、NA 的代数式表示)。
【答案】p 5s25p4 6 球形 O>Cl>C 平面三角形 sp2、sp3 13NA H2O BC 8 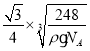
【解析】
(1) 碲(Te)与氧同族,是第VIA族元素,根据推算位置是第五周期第VIA族,属于p区元素;
(2)基态钠原子的核外电子排布式是:![]() ,共有4个能级6个轨道,最高能层是3s能级,电子云轮廓图为球形;
,共有4个能级6个轨道,最高能层是3s能级,电子云轮廓图为球形;
(3)根据元素周期律,同周期从左到右,同族从下至上电负性均增大,氧与氯在形成化合物时氧元素显负价,吸引电子能力更强,故电负性:O>Cl>C;
(4)CO32-中中心原子的价层电子对数是![]() ,不含有孤对电子,采取sp2杂化,是平面三角形构型;根据结构简式可知,碳形成单键、双键两种化学键,故碳原子采取sp2、sp3杂化;根据碳原子的成键结构,周围满足四键,故1mol 碳酸丙烯酯中σ键的数目为13NA;
,不含有孤对电子,采取sp2杂化,是平面三角形构型;根据结构简式可知,碳形成单键、双键两种化学键,故碳原子采取sp2、sp3杂化;根据碳原子的成键结构,周围满足四键,故1mol 碳酸丙烯酯中σ键的数目为13NA;
(5)根据配位化合物的结构可知,该物质的配体是:H2O,该配离子包含的作用力有氢氧极性键、配位键;答案选BC。
(6)根据原子半径大小,可判断出氧离子半径大于钠离子半径,钠位于内部,氧位于顶点和面心,以面心的氧为例,可以直接和8个钠相连,故氧的配位数是8;该物质的化学式为:Na2O,晶胞的体积为:![]() cm3,则晶胞边长是:
cm3,则晶胞边长是: cm,则Na与O之间的最短距离为
cm,则Na与O之间的最短距离为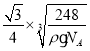 cm。
cm。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案【题目】(1)将Cl2通入水中,Cl2部分与水反应:Cl2+H2![]() OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
A.AgNO3晶体 B.CaCO3粉末 C.NaCl晶体 D.蒸馏水 E.浓盐酸
(2)在一定条件下,同时加入CO、H2O(g)、CO2、H2于一密闭容器中发生如下反应:CO+H2O(g)![]() CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
A.反应开始时,正反应速率大于逆反应速率
B.反应开始时,正反应速率最大,逆反应速率为零
C.随着反应的进行,正反应速率逐渐减小,最后为零
D.随着反应的进行,逆反应速率增大,正反应速率减小,最后相等
(3)一定条件下(温度恒定),SO2与O2反应的浓度随时间的变化如下表。
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)/(mol·L-1) | 1.0 | |||||||
c(O2)/(mol·L-1) | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
c(SO3)/(mol·L-1) | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表数据计算:
A.30~40min时间段,以SO2表示的反应速率为___;
B.该温度下,正反应的平衡常数的值为___;
C.平衡时,SO2的转化率为___。
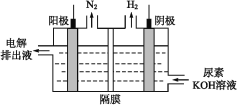
(4)电解尿素的碱性溶液制氢气的装置示意图见如图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为___。
(5)3.04g铜镁合金完全溶解于100mL密度为1.40g·cm-3、质量分数为63%的硝酸中,得到NO2气体2688mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则加入NaOH溶液的体积是___mL。