题目内容
洗车安全气囊是行车安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害.为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验.经组成分析,确定该粉末仅含Na、Fe、N、O四种元素.水溶性试验表明,固体粉末部分溶解.经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸.
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L.单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另外一种单质.化合物丙置于空气中可转化为可溶性盐和一种气态单质.请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 .
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 ;将该碳酸氢盐溶于水配成溶液,则溶液中各离子浓度大小关系为: .
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 .
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 .
A.KCl B.KNO3 C.Na2S D.CuO.
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L.单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另外一种单质.化合物丙置于空气中可转化为可溶性盐和一种气态单质.请回答下列问题:
(1)甲的化学式为
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为
(3)单质乙与红棕色粉末发生反应的化学方程式为
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是
A.KCl B.KNO3 C.Na2S D.CuO.
考点:无机物的推断
专题:推断题
分析:粉末仅含Na、Fe、N、O四种元素.水溶性试验表明,固体粉末部分溶解,经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸,则该红棕色固体是氧化铁;取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,则甲中含有两种元素,甲是可溶性物质,单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质,则乙为Na,氮气物质的量=
=0.3mol、其质量=0.3mol×28g/mol=8.4g,故Na元素质量=13g-8.4g=4.6g,物质的量=
=0.2mol,故甲中Na、N原子数目之比=0.2mol:0.3mol×2=1:3,则甲为NaN3,钠和氧化铁反应生成过氧化钠和铁,所以丙是过氧化钠,过氧化钠与空气接触可转化为碳酸钠,还有氧气生成,根据物质的性质来分析解答.
| 6.72L |
| 22.4L/mol |
| 4.6g |
| 23g/mol |
解答:
解:粉末仅含Na、Fe、N、O四种元素.水溶性试验表明,固体粉末部分溶解,经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸,则该红棕色固体是氧化铁;取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,则甲中含有两种元素,甲是可溶性物质,单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质,则乙为Na,氮气物质的量=
=0.3mol、其质量=0.3mol×28g/mol=8.4g,故Na元素质量=13g-8.4g=4.6g,物质的量=
=0.2mol,故甲中Na、N原子数目之比=0.2mol:0.3mol×2=1:3,则甲为NaN3,钠和氧化铁反应生成过氧化钠和铁,所以丙是过氧化钠,过氧化钠与空气接触可转化为碳酸钠,还有氧气生成,
(1)通过以上分析知,甲的化学式为:NaN3,丙为过氧化钠,其电子式为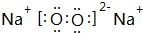 ,
,
故答案为:NaN3; ;
;
(2)丙是过氧化钠,在空气中转化为碳酸氢盐,则该反应是过氧化钠和二氧化碳、水反应生成碳酸氢钠和氧气,反应的化学方程式为2Na2O2+4CO2+2H2O=4NaHCO3+O2,碳酸氢钠溶液中碳酸氢根的水解程度大于电离程度,溶液呈碱性,且水解和电离程度都较小,主要以HCO3-形式存在,溶液中离子浓度为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:2Na2O2+4CO2+2H2O=4NaHCO3+O2;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)高温条件下,钠和氧化铁反应生成过氧化钠和铁,反应方程式为:6Na+2Fe2O3
3Na2O2+4Fe,钠和氧化铁反应时,氧化铁作氧化剂,且该反应放出大量热,能提供能量促进氮化钠分解,
故答案为:6Na+2Fe2O3
3Na2O2+4Fe,充当氧化剂,除去氮化钠分解产生的金属钠(金属钠溶于水产生大量的热和碱性有害物质),提供大量的热量用于氮化钠的迅速分解;
(4)安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,硝酸钾本身受热分解产生氮气与氧气反应,选项中能和钠反应的是氧化铜,故选:D.
| 6.72L |
| 22.4L/mol |
| 4.6g |
| 23g/mol |
(1)通过以上分析知,甲的化学式为:NaN3,丙为过氧化钠,其电子式为
 ,
,故答案为:NaN3;
 ;
;(2)丙是过氧化钠,在空气中转化为碳酸氢盐,则该反应是过氧化钠和二氧化碳、水反应生成碳酸氢钠和氧气,反应的化学方程式为2Na2O2+4CO2+2H2O=4NaHCO3+O2,碳酸氢钠溶液中碳酸氢根的水解程度大于电离程度,溶液呈碱性,且水解和电离程度都较小,主要以HCO3-形式存在,溶液中离子浓度为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:2Na2O2+4CO2+2H2O=4NaHCO3+O2;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)高温条件下,钠和氧化铁反应生成过氧化钠和铁,反应方程式为:6Na+2Fe2O3
| ||
故答案为:6Na+2Fe2O3
| ||
(4)安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,硝酸钾本身受热分解产生氮气与氧气反应,选项中能和钠反应的是氧化铜,故选:D.
点评:本题考查无机物的推断,属于计算型推断,综合考查元和化合物的知识,明确物质的性质及其颜色是解本题关键,难度较大.

练习册系列答案
相关题目
已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A、向醋酸溶液加水稀释时,醋酸的电离平衡逆向移动 |
| B、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| C、a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| D、同浓度CH3COONa和KCN溶液中c(Na+)-c(CH3COO-)小于的c(K+)-c(CN-) |