题目内容
1.8g水蒸气通过足量的Na2O2固体,固体质量增重 ;2.2g CO2气体通过足量的Na2O2固体,固体质量增重 ;5g CH2O在过量的氧气中燃烧,燃烧产物通过足量的Na2O2,固体质量增重 .
考点:化学方程式的有关计算
专题:计算题
分析:过氧化钠与水发生反应:2Na2O2+2H2O=4NaOH+O2↑,根据差量法计算固体质量增重;
过氧化钠与二氧化碳发生反应:2Na2O2+2CO2=2Na2CO3+O2,根据差量法计算固体质量增重;
由方程式可知,水与过氧化钠反应固体增重相当于氢气的质量,二氧化碳与过氧化钠反应固体增重相当于CO的质量,CH2O可以可知CO、H2混合,故燃烧后通过过氧化钠,固体增重为CH2O的质量.
过氧化钠与二氧化碳发生反应:2Na2O2+2CO2=2Na2CO3+O2,根据差量法计算固体质量增重;
由方程式可知,水与过氧化钠反应固体增重相当于氢气的质量,二氧化碳与过氧化钠反应固体增重相当于CO的质量,CH2O可以可知CO、H2混合,故燃烧后通过过氧化钠,固体增重为CH2O的质量.
解答:
解:设过氧化钠与水发生反应后固体增重为m,则:
2Na2O2+2H2O=4NaOH+O2↑ 固体增重
36 4
1.8g m
故m=
=0.2g
设过氧化钠与二氧化碳发生反应后固体增重为n,则:
2Na2O2+2CO2=2Na2CO3+O2 固体质量增重
88 56
2.2g n
n=
=1.4g;
由方程式可知,水与过氧化钠反应固体增重相当于氢气的质量,二氧化碳与过氧化钠反应固体增重相当于CO的质量,CH2O可以可知CO、H2混合,故燃烧后通过过氧化钠,固体增重为CH2O的质量,即固体质量增重5g,
故答案为:0.2g;1.4g;5g.
2Na2O2+2H2O=4NaOH+O2↑ 固体增重
36 4
1.8g m
故m=
| 1.8g×4 |
| 36 |
设过氧化钠与二氧化碳发生反应后固体增重为n,则:
2Na2O2+2CO2=2Na2CO3+O2 固体质量增重
88 56
2.2g n
n=
| 2.2g×56 |
| 88 |
由方程式可知,水与过氧化钠反应固体增重相当于氢气的质量,二氧化碳与过氧化钠反应固体增重相当于CO的质量,CH2O可以可知CO、H2混合,故燃烧后通过过氧化钠,固体增重为CH2O的质量,即固体质量增重5g,
故答案为:0.2g;1.4g;5g.
点评:本题考查化学方程式有关计算,难度中等,注意利用差量法计算,根据质量守恒理解差量法.

练习册系列答案
相关题目
将两粒相同大小的钠,一粒用铝箔包好为甲,另一粒为乙,将甲、乙两粒钠分别投入足量的水中,收集所得气体,气体的体积大小关系是( )
| A、乙多 | B、甲多 |
| C、一样多 | D、无法确定 |
关于NaHCO3溶液,下列表述不正确的是( )
| A、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| C、HCO3-的水解程度大于HCO3-的电离程度 |
| D、c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |

 图中X、Y、Z、W是地壳含量前四位(不按顺序)的元素组成的单质,其它为化合物,A有磁性.它们之间存在如下转化关系(部分产物已略去).
图中X、Y、Z、W是地壳含量前四位(不按顺序)的元素组成的单质,其它为化合物,A有磁性.它们之间存在如下转化关系(部分产物已略去).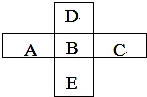 A、B、C、D、E五种主族元素所处周期表的位置如图所示.
A、B、C、D、E五种主族元素所处周期表的位置如图所示.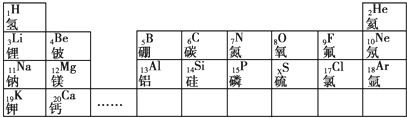
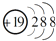 表示的是(写粒子符号)
表示的是(写粒子符号)