题目内容
已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A、向醋酸溶液加水稀释时,醋酸的电离平衡逆向移动 |
| B、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| C、a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| D、同浓度CH3COONa和KCN溶液中c(Na+)-c(CH3COO-)小于的c(K+)-c(CN-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.加水稀释促进醋酸电离;
B.酸根离子水解程度越大,相同浓度的钠盐溶液pH越大;
C.根据电荷守恒确定溶液酸碱性,从而确定a、b关系;
D.根据电荷守恒分析.
B.酸根离子水解程度越大,相同浓度的钠盐溶液pH越大;
C.根据电荷守恒确定溶液酸碱性,从而确定a、b关系;
D.根据电荷守恒分析.
解答:
解:A.加水稀释促进醋酸电离,所以醋酸电离平衡向正反应方向移动,故A错误;
B.酸根离子水解程度CO32->CN->CH3COO-,所以相同浓度的这三种钠盐溶液pH大小顺序是pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故B错误;
C.溶液中c(Na+)>c(CN-),根据电荷守恒得c(H+)<c(OH-),溶液呈碱性,溶液中的溶质可能是NaCN、NaCN和NaOH或NaCN和HCN,所以a不一定大于b,故C错误;
D.酸根离子水解程度CN->CH3COO-,则等浓度的两种溶液中c(CH3COO-)>c(CN-),结合物料守恒得c(Na+)-c(CH3COO-)小于c(K+)-c(CN-),故D正确;
故选D.
B.酸根离子水解程度CO32->CN->CH3COO-,所以相同浓度的这三种钠盐溶液pH大小顺序是pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故B错误;
C.溶液中c(Na+)>c(CN-),根据电荷守恒得c(H+)<c(OH-),溶液呈碱性,溶液中的溶质可能是NaCN、NaCN和NaOH或NaCN和HCN,所以a不一定大于b,故C错误;
D.酸根离子水解程度CN->CH3COO-,则等浓度的两种溶液中c(CH3COO-)>c(CN-),结合物料守恒得c(Na+)-c(CH3COO-)小于c(K+)-c(CN-),故D正确;
故选D.
点评:本题考查了弱电解质的电离及盐类水解,明确弱酸电离平衡常数与酸根离子水解程度的关系是解本题关键,再结合守恒思想分析解答,题目难度不大.

练习册系列答案
相关题目
下列物质属于有机物的是( )
| A、氰化钾 KCN |
| B、氰酸铵 NH4CNO |
| C、聚乙炔 (C2H2)n |
| D、碳化硅 SiC |
下列对氧化还原反应的叙述,正确的是( )
| A、氧化还原反应中,某元素由化合态变为游离态时,一定被还原 |
| B、阳离子只有氧化性,阴离子只有还原性 |
| C、氧化剂在氧化还原反应中,本身被还原 |
| D、氧化还原反应的实质是化合价的升降 |
关于NaHCO3溶液,下列表述不正确的是( )
| A、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| C、HCO3-的水解程度大于HCO3-的电离程度 |
| D、c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.估算该反应的平衡常数( )
| A、4.5×10-4 |
| B、0.015 |
| C、5.4×10-5 |
| D、无法计算 |
将一定量的甲烷完全燃烧,使所生成的气体依次通过装有足量无水CaCl2和NaOH的玻璃管.结果盛NaOH的玻璃管质量增加了1.1g,则原来甲烷在标准状况下的体积为( )
| A、2.24L |
| B、1.12L |
| C、0.56L |
| D、0.28L |
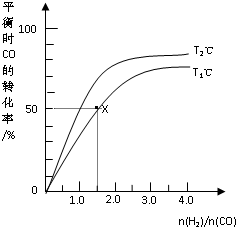 在2L的密闭容器中,起始时均投入2mol CO,在不同条件下发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.有关信息如图所示,下列说法正确的是( )
在2L的密闭容器中,起始时均投入2mol CO,在不同条件下发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.有关信息如图所示,下列说法正确的是( )| A、T1<T2 | ||
| B、T1℃时该反应的平衡常数为4.0 L2?mol-2 | ||
C、同一温度下,
| ||
D、相同条件下
|