题目内容
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE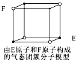
【答案】B
【解析】
A. 价电子排布为ns1的元素,为第IA族元素,一定为s区元素,故A错误;
B. Fe是26元素,其价电子数是8,每个配体CO分子提供电子数为2,则8+2n=18,解得n=5,故B正确;
C. 甲醛分子中碳原子形成了3个σ键,没有孤电子对,因此,碳原子采取sp2杂化,甲醛分子的立体构型为平面三角形,光卤气(COCl2)分子中C原子价层电子对数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面三角形,但是甲醛中与C原子连接的为2个H和1个O,光卤气中与C原子连接的为2个Cl和1个O,H和Cl的电负性不同,则键角不相同,故C错误;
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面三角形,但是甲醛中与C原子连接的为2个H和1个O,光卤气中与C原子连接的为2个Cl和1个O,H和Cl的电负性不同,则键角不相同,故C错误;
D. 团簇分子中含有4个E,4个F原子,分子式应为E4F4或F4E4,故D错误;
答案选B。

【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
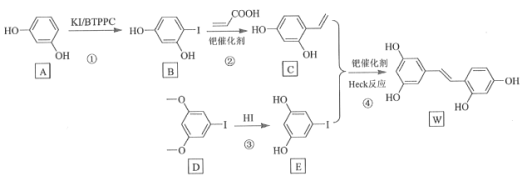
回答下列问题:
![]() 的化学名称为___________。
的化学名称为___________。
![]()
![]() 中的官能团名称是___________。
中的官能团名称是___________。
![]() 反应③的类型为___________,W的分子式为___________。
反应③的类型为___________,W的分子式为___________。
![]() 不同条件对反应④产率的影响见下表:
不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率 |
1 | KOH | DMF |
|
|
2 |
| DMF |
|
|
3 |
| DMF |
|
|
4 | 六氢吡啶 | DMF |
|
|
5 | 六氢吡啶 | DMA |
|
|
6 | 六氢吡啶 | NMP |
|
|
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
![]() 为D的同分异构体,写出满足如下条件的X的结构简式________________。
为D的同分异构体,写出满足如下条件的X的结构简式________________。
含有苯环;②有三种不同化学环境的氢,个数比为6:2:1;③1 mol的X与足量金属Na反应可生成2 g H2。