题目内容
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2=MnSO4。已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、A13+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为__________。
【答案】5.0<pH<7.1
【解析】
当铁离子浓度小于10-6mol/L,铁离子认为完全除去,c3(OH-)=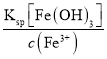 ,c(H+)=
,c(H+)=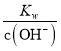 ,A13+沉淀完全时,c3(OH-)=
,A13+沉淀完全时,c3(OH-)=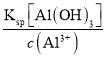 计算pH。
计算pH。
Fe3+沉淀完全,c3(OH-)=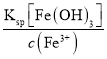 =
=![]() =10-33,c(OH-)=10-11 mol/L,c(H+)=
=10-33,c(OH-)=10-11 mol/L,c(H+)=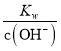 =
=![]() =10-3,pH=3.0,A13+沉淀完全时,c3(OH-)=
=10-3,pH=3.0,A13+沉淀完全时,c3(OH-)=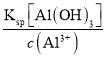
![]() =10-27,c(OH-)=10-9 ,c(H+)=
=10-27,c(OH-)=10-9 ,c(H+)=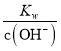 =
=![]() =10-5,pH=5.0,锰离子沉淀时pH值是7.1,所以除去杂质Fe3+、A13+调节pH值的范围是5.0~7.1,故答案为:5.0<pH<7.1。
=10-5,pH=5.0,锰离子沉淀时pH值是7.1,所以除去杂质Fe3+、A13+调节pH值的范围是5.0~7.1,故答案为:5.0<pH<7.1。

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行