题目内容
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
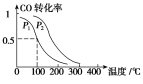
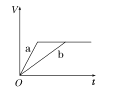
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
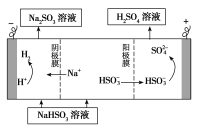
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
【答案】(1)-90.1 (2)ac
(3)①小于 ②(V/a)2 ③增大
(4)①SO2+2H2O-2e-=4H++SO42-
②HSO3-+H2O-2e-=SO42-+3H+
【解析】
试题分析:(1)①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1;②CO(g)+
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1;②CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1;③H2(g)+
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1;③H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1;根据盖斯定律,③*2+②-①可得则CO(g)+2H2(g)
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1;根据盖斯定律,③*2+②-①可得则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-90.1kJ·mol-1。(2)下列措施中能够增大上述合成甲醇反应的反应速率的是a.使用高效催化剂 c.增大体系压强 都能使反应速率加快。:(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应为放热反应,即△H<0,故答案为:<。②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol。 对于反应 CO(g)+2H2(g)
CH3OH(g) ΔH=-90.1kJ·mol-1。(2)下列措施中能够增大上述合成甲醇反应的反应速率的是a.使用高效催化剂 c.增大体系压强 都能使反应速率加快。:(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应为放热反应,即△H<0,故答案为:<。②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol。 对于反应 CO(g)+2H2(g)![]() CH3OH(g);
CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a0.5a
平衡(mol):0.5a a 0.5a
所以平衡时 ![]()
100℃时该反应的平衡常数 。③温度容积不变,向该密闭容器再增加amolCO与2amolH2,等效为开始加入2amolCO与4amolH2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大。平衡常数只受温度影响,温度不变,平衡常数不变。故答案为:增大;不变。①请写出该电池的负极是失电子的反应,电极反应式SO2+2H2O-2e-=4H++SO42-。②阳极反应是失电子的,元素的化合价升高,根据介质,其电极反应式HSO3-+H2O-2e-=SO42-+3H+。
。③温度容积不变,向该密闭容器再增加amolCO与2amolH2,等效为开始加入2amolCO与4amolH2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大。平衡常数只受温度影响,温度不变,平衡常数不变。故答案为:增大;不变。①请写出该电池的负极是失电子的反应,电极反应式SO2+2H2O-2e-=4H++SO42-。②阳极反应是失电子的,元素的化合价升高,根据介质,其电极反应式HSO3-+H2O-2e-=SO42-+3H+。

 名校课堂系列答案
名校课堂系列答案【题目】已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H22NH3 | |||
起始浓度mol/L | 1.0 | 3.0 | 0 |
2秒末浓度mol/L | 0.6 | 1.8 | a |
A. 0.2mol/(Ls) B. 0.4mol/(Ls) C. 0.6mol/(Ls) D. 0.8mol/(Ls)