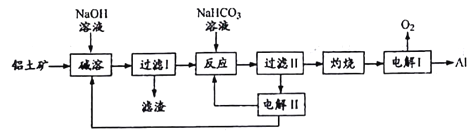
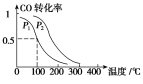
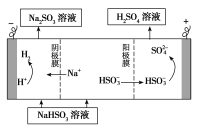
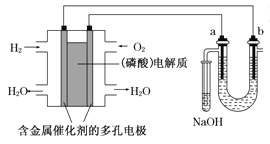
题目内容
【题目】I、在一定条件下的下列可逆反应达到平衡时,试填出:x A+y B![]() z C
z C
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是________;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向_____方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是______(填状态);
(4)如加热后,C的百分含量减小,则正反应是________热反应。
II、如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2mol Y,起始时,V(A)=V(B)= a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g) ΔH<0。达到平衡时,V(A)= 1.2a L。
2Z(g)+W(g) ΔH<0。达到平衡时,V(A)= 1.2a L。
试回答:
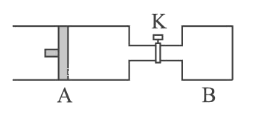
(1)A中X的转化率α(A)___________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
【答案】 x+y>z 逆反应方向(或向左移动) 固或液 放热 40% > 2.6a
【解析】I、(1)减压平衡向气体体积增大的方向移动,所以逆反应为气体体积增大的反应,则x、y、z关系是x+y>z;
(2)增压平衡向气体体积减小的方向的移动,由C是气体,并且x+y=z,则平衡必向逆反应方向移动;
(3)B、C是气体,现增加A物质的量,平衡不移动,说明A是固体或液体;
(4)加热平衡向吸热反应方向移动,由于加热后C的含量减小,则正反应为放热反应;
II、(1)40% (2)> (3)2.6a

练习册系列答案
相关题目