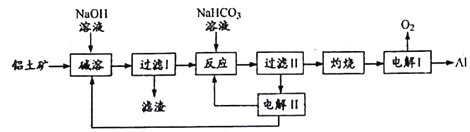
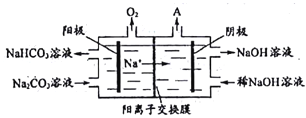
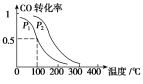
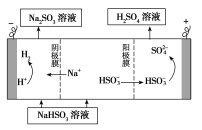
题目内容
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得溶液中加入CuO,Cu(OH)2,Cu2(OH)2CO3各0.1mol的混合物后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶液)。则电解过程中转移电子的物质的量为( )
A. 0.6mol B. 0.8mol C. 1.0mol D. 1.2mol
【答案】D
【解析】向所得溶液中加入CuO,Cu(OH)2,Cu2(OH)2CO3各0.1mol的混合物,相当于加入了0.4molCuO和0.2mol水。电解硫酸铜时,开始电解硫酸铜溶液反应生成铜、氧气和硫酸,2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,后来电解水生成氢气和氧气,2H2O
2Cu+2H2SO4+O2↑,后来电解水生成氢气和氧气,2H2O![]() 2H2↑+O2↑。如果只按照第一阶段的电解,反应只需要加入氧化铜或碳酸铜就可以,但是现在还加入了0.2mol水,这0.2mol水应该是第二阶段电解的,该阶段电解0.2mol水转移0.4mol电子,第一阶段电解生成0.4molCu和0.2mol氧气,转移0.8mol电子,所以共转移了1.2mol电子,故选D。
2H2↑+O2↑。如果只按照第一阶段的电解,反应只需要加入氧化铜或碳酸铜就可以,但是现在还加入了0.2mol水,这0.2mol水应该是第二阶段电解的,该阶段电解0.2mol水转移0.4mol电子,第一阶段电解生成0.4molCu和0.2mol氧气,转移0.8mol电子,所以共转移了1.2mol电子,故选D。

练习册系列答案
相关题目