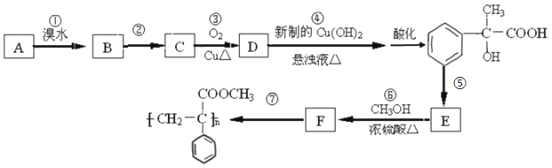
题目内容
【题目】下表是元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题
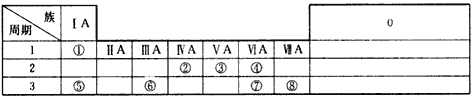
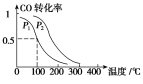
(1)⑤和⑥两种元素的原子半径大小是⑤____⑥(填“<"或“>”);
(2)由①和②两种元素组成的最简单化合物的化学式是________;
(3)⑥的单质与⑤的最高价氧化物的水化物的水溶液反应的化学方程式为____________。
【答案】 > CH4 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】试题分析:本题考查元素周期表的结构,原子半径大小的比较,化学方程式的书写。根据各编号在周期表中的位置知,①、②、③、④、⑤、⑥、⑦、⑧依次代表的元素是H、C、N、O、Na、Al、S、Cl。
(1)⑤和⑥分别是Na和Al,Na和Al都是第三周期元素,Na在IA族,Al在IIIA族,根据同周期主族元素从左到右原子半径依次减小,rNa![]() rAl,⑤
rAl,⑤![]() ⑥。
⑥。
(2)①为H元素,②为C元素,H和C组成的化合物为烃,最简单的化合物的化学式为CH4。
(3)⑤为Na元素,Na的最高价氧化物的水化物为NaOH,⑥为Al元素,Al与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。

 阅读快车系列答案
阅读快车系列答案【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
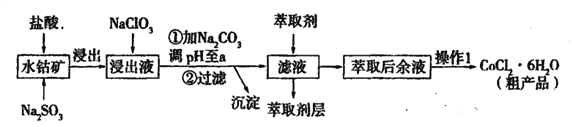
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
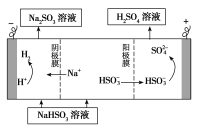
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
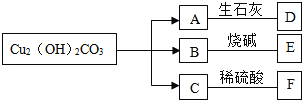
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。