题目内容
如图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象.

①浓盐酸液滴附近会出现白烟.
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是 .
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2++2NH3?H2O→Fe(OH)2↓+2NH4+和 .(化学方程式)

①浓盐酸液滴附近会出现白烟.
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2++2NH3?H2O→Fe(OH)2↓+2NH4+和
考点:氨的化学性质
专题:氮族元素
分析:氢氧化钠具有吸水性,溶于水并放热,滴加氨水,生成氨气,氨气与浓盐酸反应生成氯化铵,与浓硫酸反应生成硫酸铵或硫酸氢铵,氨气与硫酸亚铁溶液反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,以此解答.
解答:
解:②浓硫酸难挥发,能与氨气反应生成硫酸盐,则一段时间后浓硫酸的液滴中生成的白色固体为NH4HSO4或(NH4)2SO4,故答案为:NH4HSO4或(NH4)2SO4;
③FeSO4与碱反应生成白色沉淀,发生反应为Fe2++2NH3?H2O═Fe(OH)2↓+2NH4+,然后出现灰绿色沉淀,过一段时间后变成红褐色,是因氢氧化亚铁被氧化,发生反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3.
③FeSO4与碱反应生成白色沉淀,发生反应为Fe2++2NH3?H2O═Fe(OH)2↓+2NH4+,然后出现灰绿色沉淀,过一段时间后变成红褐色,是因氢氧化亚铁被氧化,发生反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评:本题以氨气的性质考查物质之间的反应,为高频考点,侧重学生分析能力的考查,注意知识的迁移应用,题目较为基础.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加,计算电极d上生成的气体,在标准状态下体积是( )升.
| A、2.8 | B、5.6 |
| C、8.4 | D、11.2 |
一定量的甲烷燃烧后生成CO、CO2、H2O(气),此混合气重49.6克,当其缓慢通过无水氯化钙时,氯化钙增重25.2克,原混合气中CO2的质量为( )
| A、12.5 克 |
| B、13.2克 |
| C、19.7克 |
| D、24.4克 |
直接NaBH4/H2O2燃料电池(DBFC)的结构如图,有关该电池的说法不正确的是( )
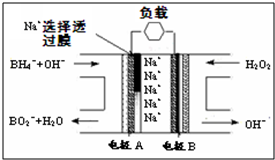

| A、电极B材料中包含MnO2层,MnO2可起催化作用 |
| B、电池负极区电极反应:BH4-+8OH--8e-═BO2-+6H2O |
| C、放电过程中,Na+从正极区向负极区迁移 |
| D、在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA个 |
(双选)将铜丝灼烧变黑后、立即插入下列物质中,铜丝变红且质量不变的是( )
| A、HNO3 |
| B、CO |
| C、C2H5OH |
| D、H2SO4 |
某烃的结构简式为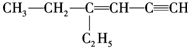 分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
 分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )| A、4、3、7 |
| B、4、3、6 |
| C、2、5、4 |
| D、4、6、4 |

 某有机物X的分子结构如图所示,请回答下列问题:
某有机物X的分子结构如图所示,请回答下列问题: