题目内容
在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,求算:(1)x值;(2)A的转化率;(3)在此温度下,求该化学反应的平衡常数k(以上题目均要求书写计算过程,带单位)
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)平衡时C的浓度为0.4mol/L,则n(C)=0.4mol/L×2L=0.8mol,结合n(D)利用物质的量之比等于化学计量数之比计算x.
(2)根据平衡时n(D),由方程式可知参加反应的n(A)=
n(D),再根据转化率定义计算A的转化率.
(3)平衡常数指指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,根据三段式计算出平衡时各组分的浓度,代入平衡常数表达式计算.
(2)根据平衡时n(D),由方程式可知参加反应的n(A)=
| 3 |
| 2 |
(3)平衡常数指指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,根据三段式计算出平衡时各组分的浓度,代入平衡常数表达式计算.
解答:
解:(1)平衡时C的浓度为0.4mol/L,则n(C)=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,所以0.8mol:0.8mol=x:2,解得x=2.
答:x值为2;
(2)平衡时n(D)=0.8mol,由方程式可知参加反应的n(A)=
n(D)=
×0.8mol=1.2mol,故A的转化率为
×100%=60%.
答:A的转化率为60%;
(3)根据三段式计算平衡时,各组分的浓度为:
3A(g)+B(g)?2C(g)+2D(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.6 0.2 0.4 0.4
平衡(mol/L):0.4 0.8 0.4 0.4
故平衡常数k=
=0.5,
答:在此温度下,该化学反应的平衡常数k为0.5.
答:x值为2;
(2)平衡时n(D)=0.8mol,由方程式可知参加反应的n(A)=
| 3 |
| 2 |
| 3 |
| 2 |
| 1.2mol |
| 2mol |
答:A的转化率为60%;
(3)根据三段式计算平衡时,各组分的浓度为:
3A(g)+B(g)?2C(g)+2D(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.6 0.2 0.4 0.4
平衡(mol/L):0.4 0.8 0.4 0.4
故平衡常数k=
| 0.42×0.42 |
| 0.43×0.8 |
答:在此温度下,该化学反应的平衡常数k为0.5.
点评:本题考查化学平衡计算、化学平衡常数等,难度中等,注意基础知识的掌握.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X的性质的描述中正确的是( )
| A、X单质易与水反应 |
| B、X形成的氧化物易与水反应生成酸 |
| C、X易形成氧化物XO |
| D、XH4的稳定性比SiH4的低 |
直接NaBH4/H2O2燃料电池(DBFC)的结构如图,有关该电池的说法不正确的是( )
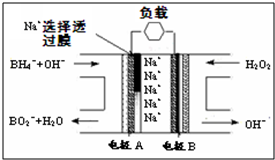

| A、电极B材料中包含MnO2层,MnO2可起催化作用 |
| B、电池负极区电极反应:BH4-+8OH--8e-═BO2-+6H2O |
| C、放电过程中,Na+从正极区向负极区迁移 |
| D、在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA个 |
2012年9月25日我国第一艘航空母舰“辽宁舰”已按计划完成建造和试验试航工作正式交付海军.目前很多核动力航母运行采用浓缩铀
U作为原料.下列有关
U的说法正确的是( )
235 92 |
235 92 |
| A、中子数为92 |
| B、质子数为92 |
| C、质子数为235 |
| D、中子数为235 |

 某有机物X的分子结构如图所示,请回答下列问题:
某有机物X的分子结构如图所示,请回答下列问题: