题目内容
有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高.取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,且能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解.
(1)甲的化学式为 ,其晶体属于 晶体.
(2)乙的水溶液俗称 ,其可以用来做 (写出一种用途).
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等.则①丁的电子式为 .
②常温下,8g的丁完全燃烧放出的热量为Q kJ,写出其燃烧热的热化学方程式为 ;
③丁与空气组成可组成碱性燃料电池,丁转化为一种稳定的气体和液体,写出该电池负极的电极反应式 .
(4)化合物戊由丙和一种酸反应得到盐,其相对式量为63.已知常温下戊的水溶液pH<7,且戊能与新制Cu(OH)2悬浊液共热有红色沉淀生成.
①戊的水溶液各离子浓度由大到小的顺序为 .
②戊与银氨溶液反应的化学方程式为 .
(1)甲的化学式为
(2)乙的水溶液俗称
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等.则①丁的电子式为
②常温下,8g的丁完全燃烧放出的热量为Q kJ,写出其燃烧热的热化学方程式为
③丁与空气组成可组成碱性燃料电池,丁转化为一种稳定的气体和液体,写出该电池负极的电极反应式
(4)化合物戊由丙和一种酸反应得到盐,其相对式量为63.已知常温下戊的水溶液pH<7,且戊能与新制Cu(OH)2悬浊液共热有红色沉淀生成.
①戊的水溶液各离子浓度由大到小的顺序为
②戊与银氨溶液反应的化学方程式为
考点:无机物的推断
专题:推断题
分析:取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,且能使湿润的红色石蕊试纸变蓝,证明丙气体为NH3,说明甲中含有氮元素;含氧酸盐乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解,说明生成的沉淀为H2SiO3,证明甲中含有硅元素,材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高,证明是一种原子晶体含有氮元素和硅元素,依据元素化合价熟悉得到甲为Si3N4,判断乙为硅酸钠,A为硅 元素,B为氮元素,B元素的一种氢化物丁,相对分子质量为32,常温下为液体,由题意可知丁为N2H4,化合物戊由丙和一种酸反应得到盐,其相对式量为63.且戊能与新制Cu(OH)2悬浊液共热有红色沉淀生成,说明戊含有醛基,是甲酸盐,丙为氨气,推断戊为甲酸铵,结合对应物质的性质以及题目要求解答该题.
解答:
解:取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,且能使湿润的红色石蕊试纸变蓝,证明丙气体为NH3,说明甲中含有氮元素;含氧酸盐乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解,说明生成的沉淀为H2SiO3,证明甲中含有硅元素,材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高,证明是一种原子晶体含有氮元素和硅元素,依据元素化合价熟悉得到甲为Si3N4,判断乙为硅酸钠,A为硅 元素,B为氮元素,(1)由以上分析可知甲为氮化硅,化学式为Si3N4,为原子晶体,
故答案为:Si3N4;原子;
(2)乙的水溶液为硅酸钠水溶液,俗称为水玻璃,是一种矿物胶,可以做黏合剂、木材等的防腐剂或防火剂,
故答案为:水玻璃;黏合剂、木材等的防腐剂或防火剂;
(3)①B元素的一种氢化物丁,相对分子质量为32,常温下为液体,由题意可知丁为N2H4,电子式为: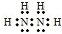 ,故答案为:
,故答案为: ;
;
②发生反应为:N2H4+O2=N2+2H2O,8g的丁完全燃烧放出的热量为Q kJ,计算1molN2H4反应放出的热量4QKJ,注明物质的聚集状态及反应热,据此书写热化学方程式为:N2H4(l)+O2(g)=N2(g)+2H2O (l)△H=-4QkJ/mol;,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-4QkJ/mol;
③N2H4与空气组成可组成碱性燃料电池,N2H4转化为一种稳定的气体和液体,应生成氮气和水,电极方程式为N2H4-4e-+4OH-=N2+4H2O,
故答案为:N2H4-4e-+4OH-=N2+4H2O;
(4)①化合物戊由丙和一种酸反应得到盐,其相对式量为63.且戊能与新制Cu(OH)2悬浊液共热有红色沉淀生成,说明戊含有醛基,是甲酸盐,丙为氨气,推断戊为甲酸铵,已知常温下戊的水溶液pH<7,说明铵根离子水解程度大于甲酸根离子水解程度,据此分析溶液中离子浓度大小为:c(HCOO-)>c(NH4+)>c(H+)>(OH-),
故答案为:c(HCOO-)>c(NH4+)>c(H+)>(OH-);
②HCOONH4含有醛基,可与银氨溶液发生氧化还原反应,反应的方程式为HCOONH4+2Ag(NH3)2OH
(NH4)2CO3+2Ag↓+3NH3+H2O,
故答案为:HCOONH4+2Ag(NH3)2OH
(NH4)2CO3+2Ag↓+3NH3+H2O.
故答案为:Si3N4;原子;
(2)乙的水溶液为硅酸钠水溶液,俗称为水玻璃,是一种矿物胶,可以做黏合剂、木材等的防腐剂或防火剂,
故答案为:水玻璃;黏合剂、木材等的防腐剂或防火剂;
(3)①B元素的一种氢化物丁,相对分子质量为32,常温下为液体,由题意可知丁为N2H4,电子式为:
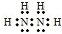 ,故答案为:
,故答案为: ;
;②发生反应为:N2H4+O2=N2+2H2O,8g的丁完全燃烧放出的热量为Q kJ,计算1molN2H4反应放出的热量4QKJ,注明物质的聚集状态及反应热,据此书写热化学方程式为:N2H4(l)+O2(g)=N2(g)+2H2O (l)△H=-4QkJ/mol;,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-4QkJ/mol;
③N2H4与空气组成可组成碱性燃料电池,N2H4转化为一种稳定的气体和液体,应生成氮气和水,电极方程式为N2H4-4e-+4OH-=N2+4H2O,
故答案为:N2H4-4e-+4OH-=N2+4H2O;
(4)①化合物戊由丙和一种酸反应得到盐,其相对式量为63.且戊能与新制Cu(OH)2悬浊液共热有红色沉淀生成,说明戊含有醛基,是甲酸盐,丙为氨气,推断戊为甲酸铵,已知常温下戊的水溶液pH<7,说明铵根离子水解程度大于甲酸根离子水解程度,据此分析溶液中离子浓度大小为:c(HCOO-)>c(NH4+)>c(H+)>(OH-),
故答案为:c(HCOO-)>c(NH4+)>c(H+)>(OH-);
②HCOONH4含有醛基,可与银氨溶液发生氧化还原反应,反应的方程式为HCOONH4+2Ag(NH3)2OH
| 水浴加热 |
故答案为:HCOONH4+2Ag(NH3)2OH
| 水浴加热 |
点评:本题考查无机物的推断,为高考常见题型,侧重于考查物质转化关系和物质性质的分析判断,主要是结构推断,性质和反应现象的理解应用,溶液中离子浓度大小比较,热化学方程式书写,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
同主族元素所形成的同一类化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中错误的是( )
| A、它是共价化合物 |
| B、在加热时,它能分解 |
| C、它能跟碱发生反应 |
| D、它可由PH3和HI化合而成 |
(双选)将铜丝灼烧变黑后、立即插入下列物质中,铜丝变红且质量不变的是( )
| A、HNO3 |
| B、CO |
| C、C2H5OH |
| D、H2SO4 |
橡胶是一种重要的战略物资,一般分为天然橡胶和合成橡胶两类.丁苯橡胶是合成橡胶的一种,其结构简式为
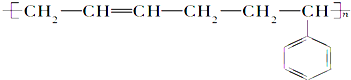
以下关于它的说法中正确的是( )
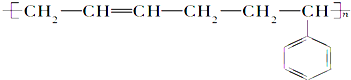
以下关于它的说法中正确的是( )
A、它的单体是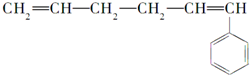 |
B、丁苯橡胶是CH2═CH-CH═CH2和 通过缩聚反应制得的 通过缩聚反应制得的 |
| C、装液溴或溴水的试剂瓶可用丁苯橡胶作瓶塞 |
| D、丁苯橡胶会老化 |

 某有机物X的分子结构如图所示,请回答下列问题:
某有机物X的分子结构如图所示,请回答下列问题: