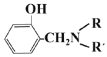
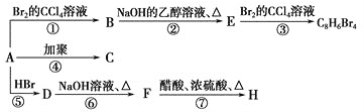
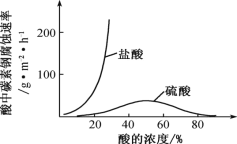
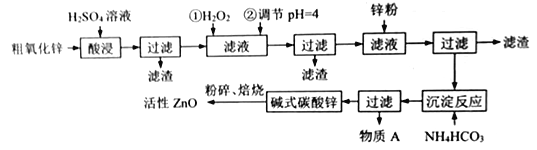
题目内容
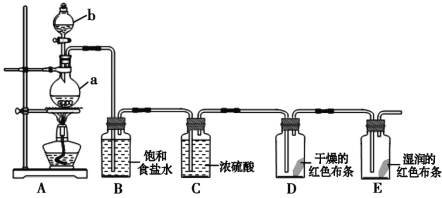
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可快速氧化 SO2。下列说法错误的是:
A.每活化一个氧分子放出 0.29 eV 能量
B.水可使氧分子活化反应的活化能降低 0.18 eV
C.氧分子的活化是氧氧共价键的断裂与碳氧共价键的生成过程
D.无水条件下该过程的活化能为 1.04 eV
【答案】D
【解析】
A. 根据能量变化图分析,氧气最终变成活化氧,体系能量降低,则每活化一个氧气分子放出0.29eV能量,A项正确;
B. 反应过程中存在多步反应的活化能,根据能量变化图分析,整个反应的活化能应是活化能较大的,则没有水加入的反应活化能E=0.75eV,有水加入反应的活化能E=0.57eV,所以水可以使氧分子活化反应的活化能降低0.75eV-0.57eV=0.18eV,B项正确;
C. 根据能量变化图和题意,氧分子活化过程中氧氧的断裂,生成碳氧键,所以氧分子的活化是氧氧的断裂与碳氧键的生成过程,C项正确;
D. 根据能量变化图分析,整个反应的活化能应是活化能较大的,则没有水加入的反应活化能E=0.75eV,D项错误;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2