题目内容
【题目】已知亚硫酸钠在空气中能被氧气氧化成硫酸钠。某兴趣小组为检验亚硫酸钠固体是否变质及探究二氧化硫的性质,设计了如下实验:

I.检验Na2SO3是否变质
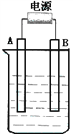
(1)往圆底烧瓶A中加入待测液1.0 mol/LNa2SO3溶液50mL溶液a为_______,溶液b为_______。
(2)向装置A中滴加足量溶液a,Na2SO3反应完全后,微热装置A使SO2完全逸出。实验前后测得C装置增重2.4g,则Na2SO3溶液物质的量浓度为_______mol/L,并判断Na2SO3固体是否变质______(填是或否)。

II.利用以上装置制备适量SO2,设计实验比较H2SO3、 H2CO3和H2SiO3的酸性强弱,并探究SO2的化学性质。
(1)试剂X是___________;试剂Y是___________;试剂Z是___________。
(2)关闭止水夹b,打开止水夹a,向装置中通入SO2,当观察到_________,即证明H2CO3酸性比H2SiO3强。
(3)关闭止水夹a,打开止水夹b,继续通入SO2,溴水褪色,说明SO2具有_______;写出相应的离子方程式______________________。
【答案】浓硫酸 浓硫酸 0.75 是 酸性高锰酸钾溶液(其他答案合理即可) 品红溶液 NaOH溶液 品红溶液不褪色,Na2SiO3溶液中有白色沉淀生成 还原性 SO2+Br2+2H2O=SO42-+2Br-+4H+
【解析】
I.装置A中的亚硫酸钠加入浓硫酸反应生成二氧化硫气体,通过装置B中浓硫酸干燥气体,用装置C吸收二氧化硫,装置D是防止空气中的水蒸气和二氧化碳干扰二氧化硫气体质量的测定,据此解答。
II.二氧化硫与碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液中生成硅酸沉淀,据此可以比较酸性强弱;二氧化硫具有还原性能被溴水氧化,根据二氧化硫有毒需要尾气处理判断。
I.(1)装置A产生二氧化硫气体,实验室一般用浓硫酸与亚硫酸钠反应生成二氧化硫气体,即a是浓硫酸。又因为生成的二氧化硫中含有水蒸气,水蒸气也能被碱石灰吸收干扰二氧化硫的检验,则通过装置B中浓硫酸干燥气体,即b是浓硫酸;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,则二氧化硫的物质的量是2.4g÷64g/mol=0.0375mol,根据硫原子守恒可知亚硫酸钠的物质的量是0.0375mol,浓度是0.0375mol÷0.05L=0.75mol/L<1.0mol/L,所以Na2SO3固体已经变质;
II.(1)二氧化硫与碳酸钠反应生成二氧化碳,但生成的二氧化碳中含有二氧化硫会干扰二氧化碳与硅酸钠的反应,需要除去,可以用酸性高锰酸钾溶液除去二氧化硫,为检验是否除尽二氧化硫需要利用品红溶液检验,即试剂X是酸性高锰酸钾溶液,试剂Y是品红溶液;二氧化硫有毒,需要尾气处理,则试剂Z是NaOH溶液。
(2)根据以上分析可知关闭止水夹b,打开止水夹a,向装置中通入SO2,当观察到品红溶液不褪色,Na2SiO3溶液中有白色沉淀生成,即证明H2CO3酸性比H2SiO3强。
(3)关闭止水夹a,打开止水夹b,继续通入SO2,溴水褪色,由于溴水具有氧化性,这说明SO2具有还原性,反应的离子方程式为SO2+Br2+2H2O=SO42-+2Br-+4H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05 g·cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
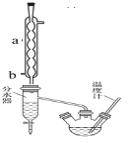
(1)制备粗产品:如图所示装置中,于50 mL圆底烧瓶中加入8.0 g苯甲酸(Mr=122)、20 mL乙醇(Mr=46,密度0.79 g·cm-3)、15 mL环己烷、3 mL浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2 h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
(2)粗产品纯化:加水30 mL,分批加入固体NaHCO3,分液,然后水层用20 mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213 ℃馏分。
相关数据如下:
沸点(℃,1 atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环己烷—水—乙醇) |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式______________________________________,仪器a的名称______________,b口为冷凝水的_____________(填“进水口”或“出水口”)。
(2)请说出在本实验中可以采取的能提高苯甲酸乙酯产率的方法_________________(写出任意一种即可)。
(3)如何利用实验现象判断反应已基本完成______________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3时的实验操作所用到的主要玻璃仪器为____________________。
(5)经精馏得210~213℃馏分7.0 mL,则实验中苯甲酸乙酯的产率为__________。