题目内容
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
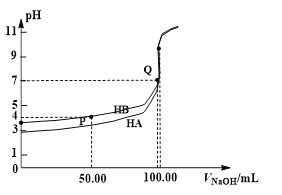
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
【答案】C
【解析】
A、等浓度的酸酸性越弱,电离出的氢离子浓度越小,pH越大,故由图可知电离常数:Ka(HA) > Ka(HB),选项A正确;B、当加入氢氧化钠为50 mL时所得溶液为HB、NaB按1:1形成的溶液,pH=4,HB的浓度约等于B-浓度Ka(HB)≈c(H+)=10-4,选项B正确;C、当PH=7时,根据电荷守恒两种溶液中离子浓度关系为: c(Na+)+c(H+)=c(A-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(A-),c(Na+)+c(H+)=c(B-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(B-),由于两种酸根的水解程度不同,则溶液呈中性时所消耗的氢氧化钠的体积不相同,则两种溶液中钠离子浓度不同,c(A-),c(B-)也不同,c(A-)>c(B-),选项C错误;D、中和分数达100%时,HA溶液中存在质子守恒有c(H+)+c(HA)=c(OH-),则![]()
,选项D正确;答案选C。

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目