题目内容
【题目】铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况)。求:
(1)混合物中铁的质量?___
(2)原稀硫酸的物质的量浓度?___
【答案】5.6g 1mol/L
【解析】
铁粉和氧化亚铁粉末的混合物中,铁粉与稀硫酸反应产生氢气,氧化亚铁与稀硫酸反应不能产生氢气,所以,可用氢气计算出铁,再用硫酸计算出氧化亚铁。
(1)设铁的质量为m(Fe),与铁反应的硫酸的物质的量为n1(H2SO4),则有:
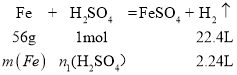
m(Fe)=5.6g,n1(H2SO4)=0.1mol,
答案为:5.6g
(2)FeO的质量m(FeO)=9.2g-5.6g=3.6g。
设与氧化亚铁反应的硫酸的物质的量为n2(H2SO4),则有:

n2(H2SO4)=0.05mol
稀硫酸的物质的量浓度为c(H2SO4)=![]() =1mol/L。
=1mol/L。
答案为:1mol/L

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目