题目内容
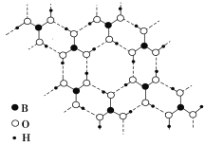
【题目】有关晶体的叙述正确的是( )
A.在24 g石墨中,含C-C共价键键数为3 mol
B.在12 g金刚石中,含C-C共价键键数为4 mol
C.在60 g二氧化硅中,含Si-O共价键键数为4 mol
D.在NaCl晶体中,与Na+最近且距离相等的Na+有6个
【答案】AC
【解析】
A. 在石墨中,每个C原子与相邻的3个C原子形成共价键,每个共价键为相邻2个C原子所共有,所以每个C原子形成的共价键数目为3×![]() =
=![]() ,24 g石墨含有的C原子的物质的量是2 mol,因此其中含有的C-C共价键的物质的量为2 mol×
,24 g石墨含有的C原子的物质的量是2 mol,因此其中含有的C-C共价键的物质的量为2 mol×![]() =3 mol,A正确;
=3 mol,A正确;
B. 在金刚石晶体中每个碳原子与相邻的4个C原子形成4个共价键,每个共价键为相邻两个C原子形成,所以其含有的C-C数目为4×![]() =2个,则在12 g金刚石含有的C原子的物质的量是1 mol,故含C-C共价键键数为2 mol,B错误;
=2个,则在12 g金刚石含有的C原子的物质的量是1 mol,故含C-C共价键键数为2 mol,B错误;
C. 二氧化硅晶体中,每个硅原子含有4个Si-O共价键,所以在60 g二氧化硅的物质的量是1 mol,则其中含Si-O共价键键数为4 mol,C正确;
D. 在NaCl晶体中,每个Na+周围与它最近且距离相等的Na+有12个,D错误;
故合理选项是AC。

【题目】下表为元素周期表的一部分。
碳 | W | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是___(写元素符号),Z原子核外电子能量最高的电子亚层是____。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是_____。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)W的氢化物与F2反应,生成一种铵盐与化合物WF3,WF3的分子构型为三角锥形。
①WF3分子为___〔填“极性”或“非极性”)分子。
②写出该反应的化学方程式,配平并标出电子转移的方向和数目:_____。
(4)硫酸工业生产中接触室内发生的反应方程式为_______;在实际生产中,操作温度选定400~500℃、压强通常采用常压的原因分别是_____。