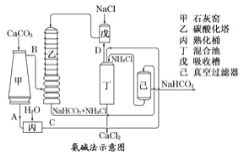
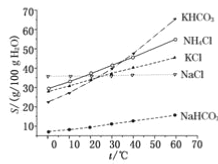
题目内容
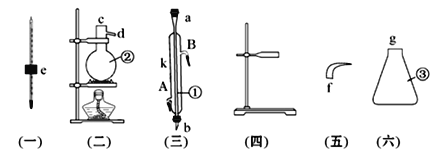
【题目】某小组利用以下装置制取并探究氨气的性质。
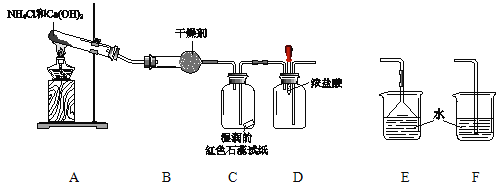
(1)A中反应的化学方程式是 。
(2)B中的干燥剂是 。
(3)C中的现象是 。
(4)实验进行一段时间后,挤压D装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是 。
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气处理装置,应选用的装置是 (填“E”或“F”)。
【答案】(1)Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+ 2H2O
CaCl2+2NH3↑+ 2H2O
(2)碱石灰 (3)湿润的红色石蕊试纸变蓝(4)产生大量白烟 (5)E
【解析】
试题分析:(1)A中反应的化学方程式是Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+ 2H2O;
CaCl2+2NH3↑+ 2H2O;
(2)氨气是碱性气体,所以B中的干燥剂应用碱石灰;
(3)氨气与水生成一水合氨,可电离出氢氧根离子,则C中的现象是湿润的红色石蕊试纸变蓝;
(4)氨气与挥发的HCl会生成氯化铵晶体,所以现象是产生大量白烟;
(5)氨气极易溶于水,所以吸收氨气时要用防倒吸装置E;

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
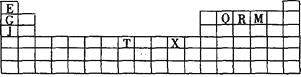

(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X |
B.将J2M2溶于水,要破坏离子键和共价键 |
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大 |
D.一个Q2E4分子中含有五个δ键和一个π键 |
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。
【题目】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
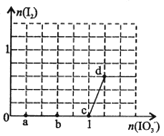
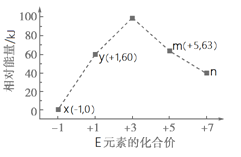
(4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如右图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。
(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)