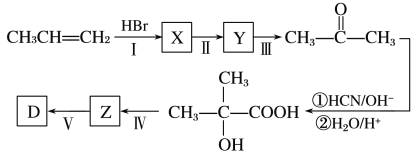
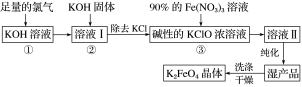
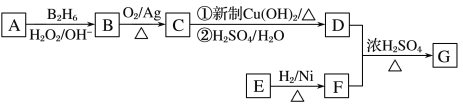题目内容
【题目】(8分)在200mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,见下图一所示。
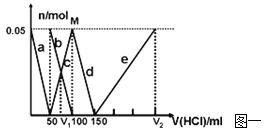
(1)原混合溶液中Na2CO3的物质的量浓度为 mol·L-1
(2)V1: V2= 。
(3)若滴加盐酸过程中得到沉淀0.975g,则滴入盐酸的体积可能为 mL。
(4)在上图二坐标中画出该混合溶液中逐滴加入1mol·L-1的盐酸,所得沉淀的物质的量与加入盐酸溶液的体积变化关系。
【答案】
(1)0.25 mol·L-1
(2)1:4
(3)12.5mL 或262.5mL
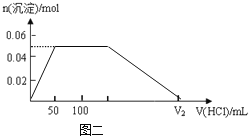
(4)
【解析】
试题分析:Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,先发生反应:AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol;第二阶段:AlO2-反应完毕,发生反应:CO32-+H+═HCO3-,b线表示CO32-,c线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol;第三阶段,CO32-反应完毕,发生反应:HCO3-+H+═CO2↑+H2O,d线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,e线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为:![]() =0.15L=150mL。
=0.15L=150mL。
(1)根据分析可知,n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol,则c(CO32-)=![]() =00.25molL-1,故答案为:0.25;
=00.25molL-1,故答案为:0.25;
(2)原溶液中n(CO32-)=0.05mol,V1时溶液中碳酸氢根离子等于碳酸根离子为0.025ml,由反应CO32-+H+═HCO3-可知,需要盐酸为0.025mol,盐酸的体积为![]() =0.025L=25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,故答案为:1:4;
=0.025L=25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,故答案为:1:4;
(3)0.975g氢氧化铝沉淀的物质的量为:![]() =0.0125mol,生成的沉淀可能为开始时只发生反应AlO2-+H++H2O═Al(OH)3↓生成的,则生成0.0125mol氢氧化铝沉淀需要消耗0.0125mol氢离子,需要滴入盐酸的体积为:
=0.0125mol,生成的沉淀可能为开始时只发生反应AlO2-+H++H2O═Al(OH)3↓生成的,则生成0.0125mol氢氧化铝沉淀需要消耗0.0125mol氢离子,需要滴入盐酸的体积为:![]() =0.0125L=12.5mL;生成的0.0125mol氢氧化铝沉淀有可能为第四阶段剩余的氢氧化铝,根据图象可知,生成氢氧化铝沉淀总消耗了150mL盐酸;氢氧化铝的总物质的量为0.05mol,反应剩余的氢氧化铝为0.0125mol,则需要溶解的氢氧化铝的物质的量为:0.05mol-0.0125mol=0.0375mol,根据反应Al(OH)3+3H+═Al3++3H2O可知,溶解0.0375mol氢氧化铝需要消耗氯化氢的物质的量为:0.0375mol×3=0.1125L=112.5mL,所以总共消耗盐酸的体积为:150mL+112.5mL=262.5mL,故答案为:12.5mL或262.5mL;
=0.0125L=12.5mL;生成的0.0125mol氢氧化铝沉淀有可能为第四阶段剩余的氢氧化铝,根据图象可知,生成氢氧化铝沉淀总消耗了150mL盐酸;氢氧化铝的总物质的量为0.05mol,反应剩余的氢氧化铝为0.0125mol,则需要溶解的氢氧化铝的物质的量为:0.05mol-0.0125mol=0.0375mol,根据反应Al(OH)3+3H+═Al3++3H2O可知,溶解0.0375mol氢氧化铝需要消耗氯化氢的物质的量为:0.0375mol×3=0.1125L=112.5mL,所以总共消耗盐酸的体积为:150mL+112.5mL=262.5mL,故答案为:12.5mL或262.5mL;
(4)根据分析可知,当加入50mL盐酸时生成了0.05mol氢氧化铝沉淀,之后氢氧化铝沉淀的物质的量暂时不变,当滴入150mL盐酸后氢氧化铝沉淀开始溶解,直至加入300mL盐酸时氢氧化铝完全溶解,据此画出所得沉淀的物质的量与加入盐酸溶液的体积变化关系的图象为: ,故答案为:
,故答案为: 。
。