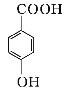题目内容
【题目】 设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.50g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA
B.12g石墨烯(如右图 )中含有C—C键的数目为1.5NA
)中含有C—C键的数目为1.5NA
C.常温下,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.一定量的Na2O2与H2O反应产生1.12L O2,则反应中转移的电子数为0.1NA
【答案】B
【解析】
试题分析:A.50g质量分数为17%的H2O2水溶液中含有水和双氧水,其中都含氧原子,氧原子数目大于0.5NA,故A错误;B.在石墨晶体中1个C原子对应3×![]() =
=![]() 个C-C键,12g石墨的物质的量为1mol,则12g石墨中含有C-C键的个数为1.5NA,故B正确;C.常温下,1L pH=13的Ba(OH)2溶液中含有OH-的浓度为0.1mol/L,数目为0.1NA,故C错误;D.未告知1.12L O2的状态,无法计算反应中转移的电子数,故D错误;故选B。
个C-C键,12g石墨的物质的量为1mol,则12g石墨中含有C-C键的个数为1.5NA,故B正确;C.常温下,1L pH=13的Ba(OH)2溶液中含有OH-的浓度为0.1mol/L,数目为0.1NA,故C错误;D.未告知1.12L O2的状态,无法计算反应中转移的电子数,故D错误;故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目