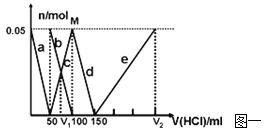
题目内容
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
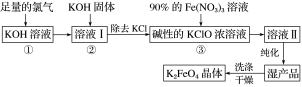
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式:________________________。
(2)在溶液Ⅰ中加入KOH固体的目的是____________(填字母)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________________________________________________。每制得59.4 g K2FeO4,理论上消耗氧化剂的物质的量为________ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:______ FeO42-+______ H2O===______ Fe(OH)3(胶体)+______ O2↑+______ OH-。
【答案】(1)2OH-+Cl2===ClO-+Cl-+H2O (2分)
(2)AC (2分)
(3)2Fe3++3ClO-+10OH-===2FeO42-+3Cl-+5H2O (2分) 0.45 (2分)
(4)4 10 4 3 8 (2分)
【解析】
试题分析:(1)氯气和氢氧化钾反应生成氯化钾、次氯酸钾和水,离子方程式为2OH-+Cl2===ClO-+Cl-+H2O。(2)氢氧化钾可以提供碱性环境也可以和溶液中溶解的过量的氯气反应生成次氯酸钾,所以选AC。(3)Fe3+被ClO-氧化成FeO42-,离子方程式为2Fe3++3ClO-+10OH-===2FeO42-+3Cl-+5H2O ;59.4 g K2FeO4的物质的量为0.3 mol,根据方程式计算次氯酸钾的物质的量为0.45 mol。(4)根据电子守恒,氢氧化铁和氧气的化学计量系数之比为4∶3,再根据质量守恒得系数,配平为4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-。

【题目】NaCl和NaClO在酸性条件下可发生反应:ClO-+ Cl-+2H+![]() Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式: 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分,从而判断该消毒液是否变质。
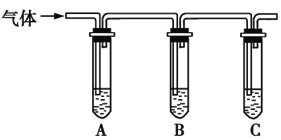
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1KI-淀粉溶液、1.0 mol·L-1NaOH溶液、澄清石灰水、饱和NaCl溶液。
请完成下列实验方案。
所加试剂 | 预期现象和结论 |
向试管A中加足量①; | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1Na2SO3溶液b mL。
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据。重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3![]() NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4
NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4![]() K2SO4+2MnSO4+5Na2SO4+3H2O。
K2SO4+2MnSO4+5Na2SO4+3H2O。
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、V的代数式表示)。
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。