题目内容
18.NA表示阿伏加德罗常数,下列说法错误的是( )| A. | 1molNH3中含有6.02×1024个电子 | |
| B. | 1mol水中含有2mol氢和1mol氧 | |
| C. | 1molOH-中含有8mol中子 | |
| D. | 2.3g钠由原子变成离子时,失去的电子数为0.1NA |
分析 A、氨气为10电子微粒;
B、指代不明;
C、氢原子中无中子;
D、求出钠的物质的量,然后根据1mol钠变为钠离子时失去1mol电子来分析.
解答 解:A、氨气为10电子微粒,故1mol氨气含10mol电子,即6.02×1024个电子,故A正确;
B、指代不明,正确的说法为1mol水中含2mol氢原子和1mol氧原子,故B错误;
C、氢原子中无中子,只有氧原子中有8个中子,故1molOH-中含8mol中子,故C正确;
D、2.3g钠的物质的量为0.1mol,而1mol钠变为钠离子时失去1mol电子,故0.1mol钠失去0.1mol电子,即0.1NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
8.依据元素周期律,下列推断中正确的是( )
| A. | KOH比NaOH碱性强 | |
| B. | H3BO3的酸性比H2CO3的酸性强 | |
| C. | HCl、H2S、H3P的还原性性逐渐减弱 | |
| D. | 若M+和R2-的核外电子层结构相同,则离子半径M+>R2- |
9.下列物质中,有共价键的单质是( )
| A. | N2 | B. | CH4 | C. | NaCl | D. | MgCl2 |
6.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 11.2 LNH3中所含的质子数为5NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| C. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA 个 |
13.有A、B、C、D四种金属,分别把它们加入到稀盐酸中,A、B、D反应后有气体放出,C无明显现象,再把A、D加入B盐溶液中,D表面有B析出,而A没有,则四种金属的活动性顺序是为( )
| A. | A>B>D>C | B. | B>D>A>C | C. | D>A>B>C | D. | D>B>A>C |
20.下列相关反应的离子方程式书写正确的是( )
| A. | 将少量醋酸加入NaAlO2溶液中:CH3COOH+AlO${\;}_{2}^{-}$+H2═CH3COO-+Al(OH)3↓ | |
| B. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+Fe3+═Fe2++S↓ |
1.下列说法中正确的是( )
| A. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| B. | 56g Fe与足量的盐酸反应转移电子数为3NA | |
| C. | 1mol铁元素转化成氢氧化铁胶体后,便有NA个氢氧化铁胶体微粒 | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
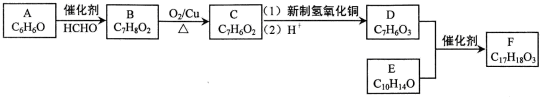
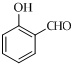 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2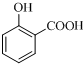 ;
;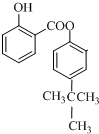 ;
; 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl