题目内容
12.下列关于Cl2性质的说法正确的是( )| A. | 密度比空气小 | B. | 是无色无味的气体 | ||
| C. | 能使干燥的有色布条褪色 | D. | 可与NaOH溶液反应 |
分析 A、氯气的密度比空气大;
B、氯气是黄绿色的气体;
C、次氯酸的漂白性,所以湿润的布条褪色;
D、氯气与氢氧化钠反应生成氯化钠和次氯酸钠.
解答 解:A、空气的相对分子量为29,氯气的密度比空气大,故A错误;
B、氯气是黄绿色的气体,故B错误;
C、次氯酸的漂白性,所以湿润的布条褪色,而不是干燥的有色布条褪色,故C错误;
D、氯气与氢氧化钠反应生成氯化钠和次氯酸钠,所以氯气可与NaOH溶液反应,故D正确;
故选D.
点评 本题考查氯气的性质,知道氯水中存在的微粒及其性质即可解答,漂白性是次氯酸的漂白性,而不是氯气,为易错点.

练习册系列答案
相关题目
9.下列物质中,有共价键的单质是( )
| A. | N2 | B. | CH4 | C. | NaCl | D. | MgCl2 |
20.下列相关反应的离子方程式书写正确的是( )
| A. | 将少量醋酸加入NaAlO2溶液中:CH3COOH+AlO${\;}_{2}^{-}$+H2═CH3COO-+Al(OH)3↓ | |
| B. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+Fe3+═Fe2++S↓ |
7.下列关于元素周期表的叙述,错误的是( )
| A. | 镁是第IIA族元素 | |
| B. | 第IA族元素全部是金属元素 | |
| C. | 氧族中含金属元素 | |
| D. | 第3周期中既有金属元素又有非金属元素 |
17.下列解释实验事实的离子方程式正确的是( )
| A. | 稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| B. | 用大理石与稀盐酸制备二氧化碳:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| C. | 用氢氧化钠溶液吸收氯气:Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 铜片放入稀硝酸中产生气体:Cu+4H++2NO${\;}_{3}^{-}$=Cu2++2NO2↑+2H2O |
4.X、Y、Z、W、M为原子序数依次增大的短周期主族元素.已知①元素对应的原子半径大小为:X<Z<Y<M<W ②原子的最外层电子数:X=W,X+Y=Z=2M ③Y元素的主要化合价:最高正价+最低负价=2,下列说法不正确的是( )
| A. | X、Z两种元素可形成X2Z和X2Z2两种常见共价化合物 | |
| B. | M与Z形成的化合物的分子式为M2Z3 | |
| C. | 工业上可用电解熔融的W的氯化物的方法制取W的单质 | |
| D. | Z元素对应的单质与W元素对应的单质在不同条件下反应产物可能不同 |
1.下列说法中正确的是( )
| A. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| B. | 56g Fe与足量的盐酸反应转移电子数为3NA | |
| C. | 1mol铁元素转化成氢氧化铁胶体后,便有NA个氢氧化铁胶体微粒 | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
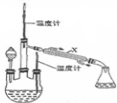 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl