题目内容
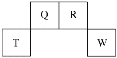
【题目】短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与族序数相等。它们最高价氧化物对应的水化物依次为甲、乙、丙、丁。下列叙述正确的是( )
A.简单离子的半径大小:W>R>T
B.含有T元素的盐溶液一定显酸性
C.W的氧化物在空气中与其他物质作用可形成光化学烟雾
D.甲、乙、丙、丁受热均易分解
【答案】A
【解析】
由短周期元素Q、R、T、W在元素周期表中的位置,可知Q、R处于第二周期,T、W处于第三周期,T所处的周期序数与主族序数相等,则T为Al,可推知Q为C元素、R为N元素、W为S元素。
由分析知:T为Al元素、Q为C元素、R为N元素、W为S元素;
A.S2-离子的核外比N3-、Al3+多一个电子层,且N3-和Al3+离子核外结构相同,核电荷数越大,离子半径越小,则离子半径由大到小的顺序为S2-> N3-> Al3+,故A正确;
B.AlCl3溶液显酸性,而NaAlO2溶液显碱性,故B错误;
C.W为S元素,而光化学烟雾是由氮的氧化物导致的,故C错误;
D.Al(OH)3、HNO3和H2CO3受热易分解,H2SO4是强酸,很稳定,受热不易分解,故D错误;
故答案为A。

 阅读快车系列答案
阅读快车系列答案【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下: 2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=___________ (用含a.b.c.d的代数式表示)。
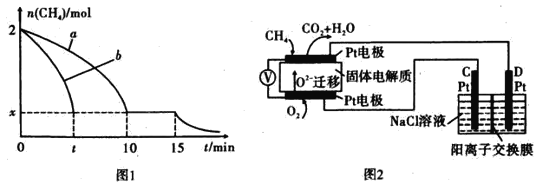
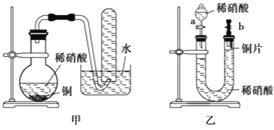
(2)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图1所示,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(填“>”“=”或“<”),判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液c(OH—)=_______ (假设电解前后溶液的体积均为500 mL)。