题目内容
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________(填序号)。
A.蛋内质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋内质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质1225 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的![]() 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
【答案】C 不属于
【解析】
(1)蛋白质水解生成氨基酸,燃烧产生烧焦羽毛气味;
(2)根据2NH3+H2SO4═(NH4)2SO4计算氮,再由氮求出蛋白质的含量。
(1)蛋白质是营养物质,提供人体所需的能量,它在人体内,可以在蛋白酶的作用下,水解成氨基酸,蛋白质还燃烧产生烧焦羽毛气味,故答案选CD;
(2)设生成的![]() 质量为x,则
质量为x,则
![]()
2 1
![]()
![]()
解得![]() ,设奶粉中蛋白质的质量分数为
,设奶粉中蛋白质的质量分数为![]() ,则
,则![]() ,所以
,所以![]() ,即100g奶粉中含蛋白质2.625g,该数值远远小于国家规定的奶粉中蛋白质含量的标准(每100g婴幼儿奶粉中含蛋白质12~25g),所以不属于合格奶粉。
,即100g奶粉中含蛋白质2.625g,该数值远远小于国家规定的奶粉中蛋白质含量的标准(每100g婴幼儿奶粉中含蛋白质12~25g),所以不属于合格奶粉。

【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=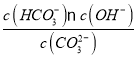 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____(填“增大”或“减小”或“不变”)。