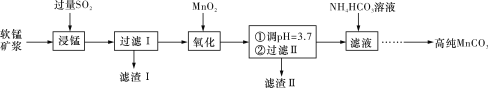
题目内容
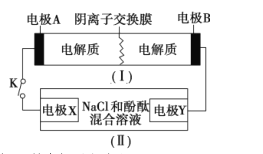
【题目】某工业废气中的SO2经如图中的两个循环可分别得到S和H2SO4。下列说法正确的是
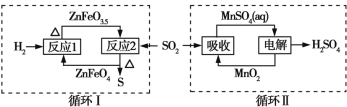
A. 循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
B. 循环Ⅰ中,反应2中的还原产物为ZnFeO4
C. Mn可作为循环Ⅱ中电解过程中的阳极材料
D. 循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
【答案】D
【解析】
A.反应1为2ZnFeO4+H2![]() 2ZnFeO3.5+H2O,氧化产物为H2O,故A错误;
2ZnFeO3.5+H2O,氧化产物为H2O,故A错误;
B.反应2为4ZnFeO3.5+SO2![]() 4ZnFeO4+S,还原产物为S,故B错误;
4ZnFeO4+S,还原产物为S,故B错误;
C.循环Ⅱ中电解时,阳极上Mn2+放电生成MnO2,若Mn作为循环Ⅱ中电解过程中的阳极材料,则阳极上Mn放电,得不到MnO2,故C错误;
D.循环I中总反应为2H2+SO2![]() S+2H2O,循环Ⅱ中电解过程发生反应为MnSO4+2H2O
S+2H2O,循环Ⅱ中电解过程发生反应为MnSO4+2H2O![]() MnO2+H2SO4+H2↑,吸收过程发生反应为MnO2+SO2=MnSO4,故循环Ⅱ中总反应为2H2O+SO2=2H2SO4+H2,循环I和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的物质的量之比为1:1,质量之比为16:49,故D正确。
MnO2+H2SO4+H2↑,吸收过程发生反应为MnO2+SO2=MnSO4,故循环Ⅱ中总反应为2H2O+SO2=2H2SO4+H2,循环I和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的物质的量之比为1:1,质量之比为16:49,故D正确。
故选D。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目