题目内容
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业上常用CO和H2合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) △H
CH3OH(g) △H
①已知:aA(g)+bB(g)=xX(g)+yY(g) △H=x△Hm[X(g)]+y△Hm[Y(g)]-a△Hm[A(g)]-b△Hm[B(g)]。
△Hm[X(g)]表示X(g)的摩尔生成焓,其余类推。25℃101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔生成焓分别为-110.5kJ·mol-1、0、-201.2kJ·mol-1,则上述反应的△H=_____。
②某温度下,向容积为2L的密闭容器中加入1molCO和2molH2,发生上述反应,CO转化率随时间的变化如图所示:
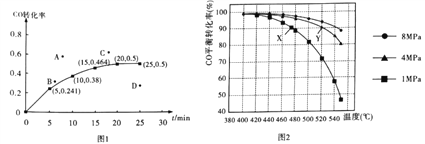
该温度下反应的平衡常数为_______;若起始压强为9MPa,则10min时容器中的压强为_______;若保持其它条件不变,起始时加入2molCO和2molH2,达到平衡,相应的点可能是上图A、B、C、D中的____。
③若只改变反应的一个条件,能使平衡体系中![]() 增大的措施有_______________(答出两点即可)。
增大的措施有_______________(答出两点即可)。
④若投料时CO与H2的物质的量之比恒定,温度、压强对CO平衡转化率的影响如图所示,如图中X点的v(逆)____________Y点的v(正)(填“>”“<”或“=”),理由是_____________。
(2)工业上常用CH3OH来制备HCOOH(甲酸)。已知25℃时,0.1mol·L-1HCOOH溶液的pH为2.3,则甲酸的电离度计算式为______;向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,会引起同样变化的是_______(填编号)。
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
【答案】 -90.7 kJ·mol-1 4.0 L2·mol-2 6.72 Mpa B 降温,加压或增加CO的浓度(1分,任答两点) < Y点对应的温度和压强(浓度)都比X点高,温度升高,或压强增大,都会加快反应速率 ![]() ×100% (或10-1.3×100%) A
×100% (或10-1.3×100%) A
【解析】(1)①根据摩尔生成焓定义可知,△H=-201.2kJ·mol-1-(-110.5kJ·mol-1)-0=-90.7 kJ·mol-1。
②由图像可知,平衡时CO的转化率为50%。根据三段式可知,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 0.5 1 0
转化浓度(mol/L) 0.25 0.5 0.25
平衡浓度(mol/L) 0.25 0.5 0.25
则该温度下反应的平衡常数为![]() =4.0 L2·mol-2。
=4.0 L2·mol-2。
10min时,CO的转化率为38%。根据三段式可知,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始物质的量(mol) 1 2 0
转化物质的量(mol) 0.38 0.76 0.38
平衡物质的量(mol) 0.62 1.24 0.38
相同的温度、体积下,压强之比等于物质的量之比,![]() =
=![]() ,解得容器中的压强为6.72 Mpa。
,解得容器中的压强为6.72 Mpa。
若保持其它条件不变,起始时加入2molCO和2molH2,化学反应速率更快,达到平衡所需时间比原平衡的短,且CO的转化率更低,故选A。
③若只改变反应的一个条件,使平衡体系中![]() 增大,可使平衡正向移动,采取的措施有降温,加压或增加CO的浓度等。
增大,可使平衡正向移动,采取的措施有降温,加压或增加CO的浓度等。
④由图可知,图像上各点都为对应温度下的平衡点,即正逆反应速率相等。Y点对应的温度和压强(浓度)都比X点高,温度升高,或压强增大,都会加快反应速率,所以图中X点的v(逆)<Y点的v(正)。
(2)25℃时,0.1mol·L-1HCOOH溶液的pH为2.3,则氢离子浓度为10-2.3 mol·L-1,所以已电离的甲酸浓度为10-2.3 mol·L-1,则甲酸的电离度为![]() ×100%。
×100%。
向0.1mol·L-1HCOOH溶液中加水,甲酸的电离平衡正向移动,电离程度增大,但c(H+)减小,溶液的pH增大,溶液的导电能力减弱,c(OH-)增大;加入少量HCOONa晶体时,平衡逆向移动,电离程度减小,c(H+)减小,溶液的pH增大,溶液的导电能力增强,c(OH-)增大;故选A。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案