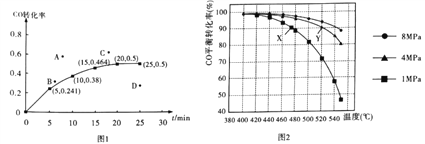
题目内容
【题目】25℃时,调节2.0×10-3 mol/L氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。请结合图中信息回答下列问题:
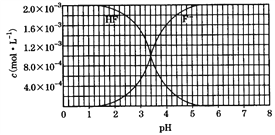
(1)HF电离平衡常数的表达式:Ka=_________。室温下,向HF溶液中滴加NaOH溶液至pH=3.4时,c(F-)∶c(HF) =_______。HF 的电离常数值为_______。
(2)将4.0×10-3mol/L的HF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生:
______________________________。[已知Ksp(CaF2)=1.5×10-10 ]
【答案】 ![]() 1∶1 10-3.4或4.0×10-4(取pH=4时,查图中数据计算得到) c(Ca2+)×c2(F-)=(2.0×10-4)×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),有沉淀产生(F-的浓度根据pH=4查图可得)
1∶1 10-3.4或4.0×10-4(取pH=4时,查图中数据计算得到) c(Ca2+)×c2(F-)=(2.0×10-4)×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),有沉淀产生(F-的浓度根据pH=4查图可得)
【解析】(1)HF电离方程式为HF![]() F-+H+,因此平衡常数的表达式:Ka=
F-+H+,因此平衡常数的表达式:Ka=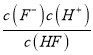 。由图象可知,当pH=4时,c(H+)=1.0×10-4mol/L,c(HF)=4.0×10-3mol/L,c(F-)=1.6×10-3mol/L,则Ka(HF)=
。由图象可知,当pH=4时,c(H+)=1.0×10-4mol/L,c(HF)=4.0×10-3mol/L,c(F-)=1.6×10-3mol/L,则Ka(HF)=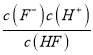 =1×104×1.6×103/4.0×104=4.0×10-4。室温下,向HF溶液中滴加NaOH溶液至pH=3.4时,氢离子浓度是10-3.4mol/L,则根据电离常数可知c(F-)∶c(HF) =
=1×104×1.6×103/4.0×104=4.0×10-4。室温下,向HF溶液中滴加NaOH溶液至pH=3.4时,氢离子浓度是10-3.4mol/L,则根据电离常数可知c(F-)∶c(HF) =![]() 。(2)将4.0×10-3mol/L的HF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节溶液pH=4,此时c(F-)=c(HF)×4.0×104/c(H+)=[2.0×103c(F)]×4.0×104/1×104,解得c(F-)=1.6×10-3(mol/L),c(Ca2+)=2.0×l0-4mol/L,则溶液中c(Ca2+)c2(F-)=2.0×l0-4×(1.6×10-3)2=5.12×10-10>ksp(CaF2)=1.5×10-10,则有沉淀生成。
。(2)将4.0×10-3mol/L的HF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节溶液pH=4,此时c(F-)=c(HF)×4.0×104/c(H+)=[2.0×103c(F)]×4.0×104/1×104,解得c(F-)=1.6×10-3(mol/L),c(Ca2+)=2.0×l0-4mol/L,则溶液中c(Ca2+)c2(F-)=2.0×l0-4×(1.6×10-3)2=5.12×10-10>ksp(CaF2)=1.5×10-10,则有沉淀生成。

 名校课堂系列答案
名校课堂系列答案