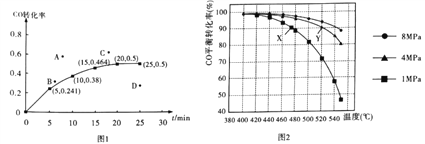
题目内容
【题目】利用铅蓄电池对下图装置进行供电,能模拟植物光合作用,将简单无机物转化为O2和C3H8O,下列说法不正确的是
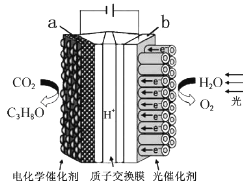
A. 该装置实现了将太阳能、电能转化为化学能
B. b极上每生成0.1molO2,铅蓄电池的负极增重19.2g
C. a极上每生成0.1molC3H8O,有1.8mol电子发生转移
D. 质子交换膜的作用是传导电子、平衡电荷,沟通回路
【答案】D
【解析】A、根据装置图,该装置实现了太阳能、电能转化为化学能,故A说法正确;B、根据装置图,b极反应式为2H2O-4e-=O2↑+4H+,铅蓄电池的负极反应式为Pb+SO42--2e-=PbSO4,生成0.1molO2,转移电子物质的量0.4mol,则铅蓄电池负极上有0.4/2mol=0.2molSO42-参与反应,质量增加0.2×96g=19.2g,故B说法正确;C、根据装置图,CO2→C3H8O,C3H8O中C的化合价为-2价,因此生成0.1molC3H8O,转移电子物质的量为0.1×3×6mol=1.8mol,故C说法正确;D、质子交换膜允许质子通过,没有电子的通过,故D说法错误。

练习册系列答案
相关题目