题目内容
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。请回答下列问题:
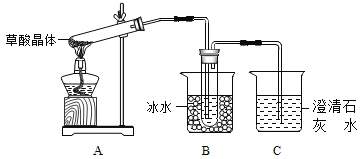
(1)甲组同学按照上图所示装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_______,由此可知草酸晶体分解的产物中有__________。装置B的主要作用是_____________。
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
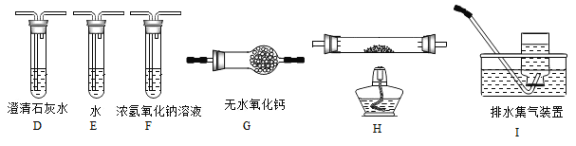
①乙组同学的实验装置中,依次连接的合理顺序为A、B_____________。
装置H反应管中盛有的物质是_________________。
②能证明草酸晶体分解产物中有CO的现象是_________________。
(3)设计实验证明:
①草酸的酸性比碳酸的强_____________。
②草酸为二元酸___________________。
(4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4溶液、MnO2氧化,锰元素被还原为+2价。KMnO4溶液和草酸钠溶液在稀硫酸中反应的离子方程式为:________________。
实验室常用固体草酸钠测定KMnO4溶液的浓度。准确称取0.2000g草酸钠,放入锥形瓶中,加入100mL稀硫酸溶解,用配制好的KMnO4溶液滴定,三次重复实验消耗KMnO4溶液的体积分别是16.02mL、16.00 mL、16.01 mL,则KMnO4溶液的物质的量浓度的计算式是:c(KMnO4)=_______________。
【答案】 有气泡逸出,澄清石灰水变浑浊 CO2 防止草酸进入装置C反应生成沉淀,干扰CO2的检验 F、D、G、H、D、I CuO H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊 向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生 用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量为草酸的2倍 2M n O4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O 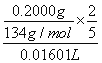
【解析】(1)装置C中可观察到的现象是有气泡逸出,澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有CO2。由于草酸易升华,能与石灰水反应生成沉淀,则装置B的主要作用是防止草酸进入装置C反应生成沉淀,干扰CO2的检验。(2)①由装置A、B出来的气体含有CO2、CO,容易想到用灼热氧化铜来氧化CO,进而检验其产物CO2。但要注意到原产物中有CO2,故要设计除去CO2和验证CO2除尽的环节,所以依次连接的合理顺序为A、B、F(除CO2)、D(验证CO2被除尽)、G(干燥,这是气体进入加热装置的常规要求)、H(氧化CO)、D(验证H中生成的CO2来证明CO的存在)、I(尾气处理);根据以上分析可知装置H反应管中盛有的物质是CuO。②CO具有还原性,能还有氧化铜生成铜和CO2,则能证明草酸晶体分解产物中有CO的现象是H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊。(3)①根据较强酸制备较弱酸可知证明草酸的酸性比碳酸的强的实验方案是向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生,说明草酸的酸性强于碳酸。②要证明草酸为二元酸需要利用中和反应,即用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量为草酸的2倍即可说明草酸为二元酸。(4)根据原子守恒和电子得失守恒可知KMnO4溶液和草酸钠溶液在稀硫酸中反应的离子方程式为2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O。消耗标准液体积的平均值是(16.02mL+16.00 mL+16.01 mL)/3=16.01 mL,根据方程式可知KMnO4溶液的物质的量浓度的计算式是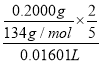 。
。