题目内容
【题目】钛酸钡(BaTiO3)是一种强介电化合物,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶 瓷工业的支柱”。
Ⅰ、固相合成法是钛酸钡的传统制备方法,典型的工艺是将等物质的量的碳酸钡和二氧化钛混合,在1500℃下反应 24 小时。
(1)写出发生反应的化学方程式:_____。
(2)该工艺的优点为工艺简单,不足之处为_____。
Ⅱ、工业上还可以 BaCO3、TiCl4 为原料,采用草酸盐共沉淀法制备草酸氧钛钡晶体[BaTiO(C2O4)24H2O],再高温煅烧制得钛酸钡粉末,其制备工业流程如图所示。
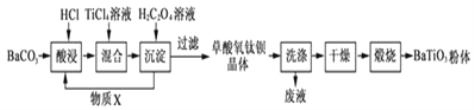
(3)为提高 BaCO3 的酸浸率,可采取的措施为_____ (任答一点)。
(4)加入 H2C2O4 溶液时,可循环使用的物质 X 是_____。
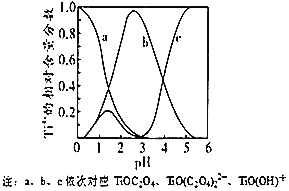
(5)研究表明,钛离子在不同 pH 下可以 TiO(OH)+、TiOC2O4 或 TiO(C2O4)2等形式存在(如图),所以在制备草酸氧钛钡晶体时要用到氨水调节混合溶液的 pH. 请结合图示信息分析,混合溶液的最佳 pH 为_____左右。
(6)高温煅烧草酸氧钛钡晶体[BaTiO(C2O4)24H2O]得到 BaTiO3 的同时,生成高温气体产物有 CO、_____和_____。成都七中某兴趣小组在实验室里模拟“高温煅烧”操作时所使用的陶瓷仪器有_____。
(7)将 TiCl4 水解产物加热脱水可生成 TiO2,写出 TiCl4 水解的化学方程式:_____。
【答案】BaCO3+TiO2![]() BaTiO3+CO2↑ 高温煅烧能耗大,对设备要求高 将碳酸钡固体粉碎、搅拌、适当升温等 HCl 3 CO2 H2O(g) 坩埚、泥三角 TiCl4+(2+x)H2O=TiO2xH2O↓+4HCl
BaTiO3+CO2↑ 高温煅烧能耗大,对设备要求高 将碳酸钡固体粉碎、搅拌、适当升温等 HCl 3 CO2 H2O(g) 坩埚、泥三角 TiCl4+(2+x)H2O=TiO2xH2O↓+4HCl
【解析】
Ⅰ、反应在高温下进行,消耗能源较多,涉及反应为BaCO3+TiO2![]() BaTiO3+CO2↑;
BaTiO3+CO2↑;
Ⅱ、由制备流程可知,碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)24H2O,过滤、洗涤、干燥、煅烧得到BaTiO3,以此解答该题。
Ⅰ、(1)涉及反应为BaCO3+TiO2![]() BaTiO3+CO2↑,
BaTiO3+CO2↑,
故答案为:BaCO3+TiO2![]() BaTiO3+CO2↑;
BaTiO3+CO2↑;
(2)反应在高温下进行,消耗能源较多,对设备要求高,
故答案为:高温煅烧能耗大,对设备要求高;
Ⅱ、(3)为提高 BaCO3 的酸浸率,可将碳酸钡固体粉碎、搅拌、适当升温等,
故答案为:将碳酸钡固体粉碎、搅拌、适当升温等;
(4)酸浸时消耗HCl、生成草酸氧钛钡时生成HCl,所以能循环的物质X是HCl,
故答案为:HCl;
(5)由图象可知pH=3时TiO(C2O4)2含量较高,
故答案为:3;
(6)BaTiO(C2O4)24H2O煅烧,发生分解反应,由元素守恒可知,生成高温下的气体产物有CO、CO2、H2O(g),煅烧时需要坩埚、泥三角等陶瓷仪器,
故答案为:CO2;H2O(g);坩埚、泥三角;
(7)TiCl4水解生成TiO2xH2O,同时生成HCl,水解方程式为:TiCl4+(2+x)H2O=TiO2xH2O↓+4HCl,
故答案为:TiCl4+(2+x)H2O=TiO2xH2O↓+4HCl。