题目内容
【题目】CH4是重要的清洁能源和化工原料,CH4和CO2都是产生温室效应的主要气体,且前者影响更大。
(1)二氧化碳的电子式为______________。
(2)25℃、101Kpa下,1g CH4完全燃烧生成液态水和CO2放热55.64kJ,则表示CH4燃烧热的热化学方程式为:__________________________________。
(3)CH4和CO2反应可以生成价值更高的化工产品,在250℃、以镍合金为催化剂,向2L密闭容器中通入4mol CH4和6mol CO2发生反应如下:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。平衡时甲烷的物质的量为1mol。
2CO(g)+2H2(g)。平衡时甲烷的物质的量为1mol。
①计算此温度下,该反应的平衡常数K=_________mol2/L2。
②下列各项不能说明该反应处于平衡状态的是_________。
A.容器中的压强恒定 B CH4的转化率恒定
C.容器中气体的密度恒定 D. CH4与CO物质的量之比恒定
(4)甲烷-空气碱性(KOH为电解质)燃料电池的负极反应式为_________________。相同条件下甲烷燃料电池与氢气燃料电池的能量密度之比为________。(能量密度之比等于单位质量可燃物完全反应转移的电子数之比)
(5)科学家以CO2和H2为原料合成乙烯,6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H20(g),已知温度对CO2平衡转化率和催化剂催化效果的影响如图所示,请回答下列问题:
CH2=CH2(g)+4H20(g),已知温度对CO2平衡转化率和催化剂催化效果的影响如图所示,请回答下列问题:
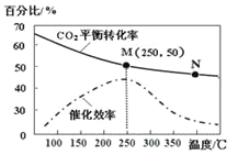
①生成乙烯的速率:v(M)有可能大于v(N),其理由是_________________。
②若投料比n(H2):n(CO2)=4:1,则图中M点时,C2H4的体积分数为_______%。
③若想提高C2H4的产率,可采取的措施有___________________。
【答案】![]() CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=-890.24kJ·mol-1 108(mol·L-1)2 C CH4-8e-+10OH-=CO32-+7H2O 1:2 随温度升高,催化剂的催化效率(或活性)降低 5.88 低温 高压 及时移走生成物
CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=-890.24kJ·mol-1 108(mol·L-1)2 C CH4-8e-+10OH-=CO32-+7H2O 1:2 随温度升高,催化剂的催化效率(或活性)降低 5.88 低温 高压 及时移走生成物
【解析】
(1)二氧化碳分子中存在两个碳氧双键,其电子式为![]() ;
;
(2)1g CH4完全燃烧生成液态水和CO2气体,放出55.64kJ的热量,则1mol即16g CH4完全燃烧生成液态水和CO2气体,16×55.64kJ=890.24kJ,则甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.24kJmol-1;
(3)①向2L密闭容器中通入4mol CH4和6mol CO2发生反应如下:CH4(g)+CO2(g)2CO(g)+2H2(g)。平衡时甲烷的物质的量为1mol,列三段式:
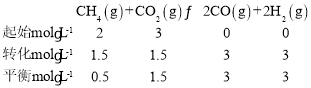
平衡常数K=![]() (molL-1)2=108(molL-1)2;
(molL-1)2=108(molL-1)2;
②A.反应前后气体体积变化,容器中的压强恒定说明反应达到平衡状态,故A不选;
B. CH4的转化率恒定是平衡标志,故B不选;
C.反应前后气体质量和体积不变,容器中气体的密度始终恒定,不能说明反应达到平衡状态,故C选;
D.CH4与CO反应的物质的量之比1:2,CH4与CO物质的量之比恒定,能说明正逆反应速率相同,故D不选;
故答案为C;
(4)甲烷-空气碱性(KOH为电解质)燃料电池负极甲烷失电子发生氧化反应,电解质为碱性,所以生成碳酸盐,负极反应式为CH4-8e一+10OH-=CO32-+7H2O;
设甲烷和氢气质量为16g,则根据电极反应计算电子转移总数可得到能量密度之比,根据方程式CH4-8e一+10OH-=CO32-+7H2O,16g甲烷燃烧电子转移8mol,根据方程式H2-2e-=2H+,16g氢气物质的量8mol,电子转移16mol,所以相同条件下,甲烷燃料电池与氢气燃料电池的能量密度之比为8:16=1:2;
(5)①化学反应速率随温度的升高而加快,但温度过高催化剂的催化效率降低,所以v(M)有可能大于v(N);
②设开始投料n(H2)为4mol,则n(CO2)为1mol,在M点平衡时二氧化碳的转化率为50%,则转化的n(CO2)=0.5mol,剩余的n(CO2)=0.5mol,根据方程式6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g),可知转化的n(H2)=1.5mol,剩余的n(H2)=2.5mol,生成的n(CH2=CH2)=0.25mol,生成的n(H2O)=1mol,所以氢气的体积分数为
CH2=CH2(g)+4H2O(g),可知转化的n(H2)=1.5mol,剩余的n(H2)=2.5mol,生成的n(CH2=CH2)=0.25mol,生成的n(H2O)=1mol,所以氢气的体积分数为![]() ×100%=5.88%;
×100%=5.88%;
③温度升高二氧化碳转化率降低,说明正反应为放热反应,故降低温度可使平衡右移增大乙烯产率;该反应为压强减小的反应,故增大压强可使平衡右移增大乙烯产率;及时移走生成物也可使平衡右移增大乙烯产率。