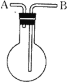题目内容
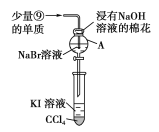
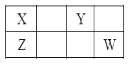
【题目】四种短周期元素X、Y、Z和 W在元素周期表中的位置如下图所示, 其最外层电子数之和为21。下列说法中正确的是
A. 单质W可由海水作原料获得
B. Y 的非金属性比 X的强,所以Y的氢化物一定比 X的更稳定
C. 工业上常利用单质 X与含 Z氧化物的矿石在高温下反应制备高纯 Z
D. X的氢化物可以与 W的单质发生反应,但是不能与 W 的氢化物发生反应
【答案】A
【解析】
假设X原子最外层电子数为a,则Y原子最外层电子数为a+2,Z原子最外层电子数为a,W原子最外层电子数为a+3,a+(a+2)+a+(a+3)=21,解得a=4,所以X是C元素,Y是O元素,Z是Si元素,W是Cl元素。
A.Cl元素单质Cl2可通过电解饱和食盐水或电解熔融的NaCl获得,A正确;
B.元素的非金属性Y>X,但Y的氢化物H2O2不稳定,受热容易分解,而C元素的氢化物CH4比较稳定,所以Y的氢化物不一定比 X的更稳定,B错误;
C.在工业上用焦炭与SiO2在高温下发生置换反应产生Si和CO,这种方法只能得到粗硅,C错误;
D. X的氢化物CH4与Cl2在光照时发生取代反应,X的氢化物CH2=CH2可以与HCl在一定条件下发生加成反应,D错误;
故合理选项是A。

【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在 100 mL 稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在 0~1、1~2、2~3、3~4、4~5 min 各时间段中:反应速率最大的时间段是_______________; 在 0~5min 内,反应速率变化的原因是______________________________________________________________________________________
(2)在 2~3 min 时间段内,用盐酸的浓度变化表示的反应速率为_______________
(3)为了减缓反应速率但不减少产生气的量,在盐酸中分别加入等体积的下列液体:
A.蒸馏水 B.Na2SO4 溶液 C.NaOH 溶液 D.H2SO4 溶液 E.Na2CO3
你认为可行的是(填编号)_______________。
(4)为了加快锌和盐酸的反应,采用了如图的装置。

此装置中负极为_______________,写出正极的电极反应式______________;
若收集到标况下 2.24L 气体,转移了电子_______________________mol,溶解了Zn______________g.
【题目】下列实验操作、现象和结论均正确且存在因果关系的是
选项 | 实验操作和现象 | 实验结论 |
A | 常温下,取浓度均为0.2mol/L的Na2CO3和NaHCO3溶液各2mL于试管中,分别滴加几滴酚酞试液,后者红色更深。 | 相同温度下,CO32-结合H+能力更强 |
B | 向Na2CrO4溶液中滴加浓硫酸,溶液由橙色变成黄色。 | 增大反应物浓度 平衡正向移动 |
C | 向硅酸钠溶液中通入CO2气体,溶液变浑浊 | 酸性:H2CO3>H2SiO3 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
A.AB.BC.CD.D