题目内容
【题目】氯化亚砜(SOCl2)在农药、制药行业中用途广泛,沸点为77℃,遇水剧烈反应,液面上产生白雾,并产生带有刺激性气味的气体。实验室用干燥的Cl2和SO2与SCl2反应合成SOCl2,反应原理是:SO2+Cl2+SCl2=2SOCl2。回答以下问题:
Ⅰ.氯化亚砜的制备
实验室拟用以下装置完成氯化亚砜的制备:
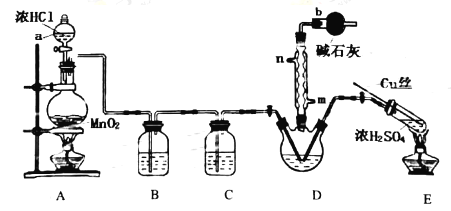
(1)仪器a的名称是__;装置D中冷凝管的冷凝水入口是__。
(2)装置A中反应的离子方程式__;装置E中反应的化学方程式__。
(3)B、C所盛试剂分别是__、__;装置D中干燥管b的作用是__。
(4)本实验的主要副产物是SCl2,已知:SOCl2沸点为77℃,SCl2的沸点为50℃,提纯SOCl2的实验操作是__;
Ⅱ.氯化亚的性质与检测
经分析,某实验小组的同学认为,SOCl2与水反应后的溶液中有盐酸和亚硫酸生成。
(5)欲证明SOCl2与水反应后形成的溶液中有H2SO3生成,可以使用的试剂是__;欲证明纯净SOCl2与水反应后形成的溶液中有Cl-,实验的操作方法是__。
【答案】分液漏斗 m MnO2+4H++2Cl-![]() Mn2++Cl2+2H2O Cu+2H2SO4(浓)
Mn2++Cl2+2H2O Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ 饱和NaCl溶液 浓H2SO4 吸收逸出的Cl2、SO2,防止空气中的水蒸气进入烧瓶,导致SOCl2水解 蒸馏 品红溶液(FeCl3、Ba(OH)2等) 反应后形成的溶液于试管中,加入足量的Ba(NO3)2溶液,充分振荡,静置,再滴入AgNO3,若产生白色沉淀,说明反应形成的浪液中有Cl-
CuSO4+2H2O+SO2↑ 饱和NaCl溶液 浓H2SO4 吸收逸出的Cl2、SO2,防止空气中的水蒸气进入烧瓶,导致SOCl2水解 蒸馏 品红溶液(FeCl3、Ba(OH)2等) 反应后形成的溶液于试管中,加入足量的Ba(NO3)2溶液,充分振荡,静置,再滴入AgNO3,若产生白色沉淀,说明反应形成的浪液中有Cl-
【解析】
根据实验原理及装置图分析,A装置为制取氯气的装置,B、C中分别装有饱和NaCl溶液 和浓H2SO4,目的是除去氯气中HCl和水;E为制取二氧化硫的装置,将氯气和二氧化硫气体同时通入D中与SCl2反应得到SOCl2,据此分析解答。
(1)根据仪器的构造分析,仪器a的名称是分液漏斗;若使冷凝管中充满冷凝水,则冷凝水入口是m,故答案为:分液漏斗; m;
(2)装置A为实验室制备氯气的装置,反应的离子方程式为:MnO2+4H++2Cl![]() Mn2++Cl2+2H2O ;装置E是用浓硫酸和铜制备二氧化化硫,反应的化学方程式为:Cu+2H2SO4(浓)
Mn2++Cl2+2H2O ;装置E是用浓硫酸和铜制备二氧化化硫,反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑,故答案为:MnO2+4H++2Cl-
CuSO4+2H2O+SO2↑,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2+2H2O;Cu+2H2SO4(浓)
Mn2++Cl2+2H2O;Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(3)制备氯气过程中会有HCl、水蒸气产生,所以B、C所盛试剂分别是饱和NaCl溶液;浓H2SO4;根据题给信息知SOCl2易水解,且未完全反应的Cl2、SO2有毒,所以装置D中干燥管b的作用是吸收逸出的Cl2、SO2,防止空气中的水蒸气进入烧瓶,导致SOCl2水解,故答案为:饱和NaCl溶液;浓H2SO4;吸收逸出的Cl2、SO2,防止空气中的水蒸气进入烧瓶,导致SOCl2水解;
(4)根据混合物的沸点不同分析,提纯SOCl2的实验操作是蒸馏,故答案为:蒸馏;
(5)H2SO3可以使品红溶液褪色,可以还原FeCl3使之褪色,可以与Ba(OH)2反应生成白色沉淀,所以使用的试剂是品红溶液(FeCl3、Ba(OH)2等);检验Cl-存在时,为了排除SO32-的干扰,先加入足量的Ba(NO3)2溶液,充分振荡,静置,再滴入AgNO3,故答案为:品红溶液(FeCl3、Ba(OH)2等);反应后形成的溶液于试管中,加入足量的Ba(NO3)2溶液,充分振荡,静置,再滴入AgNO3,若产生白色沉淀,说明反应形成的溶液中有Cl-。