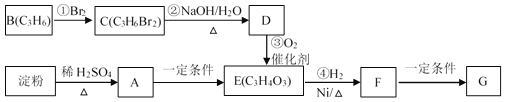
题目内容
【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
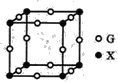
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。
【答案】分子 sp2 ![]() 四面体
四面体 ![]() Cu3N
Cu3N 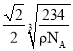
【解析】
(1)SeO2在常温下是白色的晶体,熔点为340-350℃,熔点低,为分子晶体,SeO2中Se原子价层电子对=2+![]() (6-2×2)=3,Se原子采取的杂化类型为sp2杂化,故答案为:分子,sp2。
(6-2×2)=3,Se原子采取的杂化类型为sp2杂化,故答案为:分子,sp2。
(二)有A、X、Y、Z、W、M、G等原子序数依次增大的前四周期元素,A原子核外电子总数与其周期数相同,则A是H;X基态原子的L层中有3个未成对电子,所以X是N;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反,所以Y是O;Z原子核外p电子数比s电子数多l个,则Z是Na;W原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817,I3=2745,I4=11575,这说明最高价是+3价,则W是Al;M元素的主族数与周期数相差4,则M是Cl;G基态原子最外层电子数为1,其余各电子层均充满电子,因此G是Cu。
(1)基态铝原子的核外电子数是13,则其核外电子排布图为![]() ,故答案为:
,故答案为:![]() 。
。
(2)H2O分子中O的价层电子对数=2+(6-2×1)/2=4,所以VSEPR模型名称为四面体,故答案为:四面体。
(3)已知为N2O分子中O原子只与一个N原子相连,与CO2互为等电子体,则其电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(4)根据晶胞结构可知N原子个数=8×1/8=1,Cu原子个数=12×1/4=3,因此其化学式为Cu3N,故答案为:Cu3N。
(5)氯化钠晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的钠离子中心间距离为面对角线的一半。晶胞中含有离子的个数均是4个,则晶胞边长是 ,则晶体中两个距离最近的钠离子中心间距离为
,则晶体中两个距离最近的钠离子中心间距离为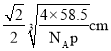 ,故答案为:
,故答案为: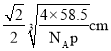 。
。

【题目】以黄铜矿(主要成分为 CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
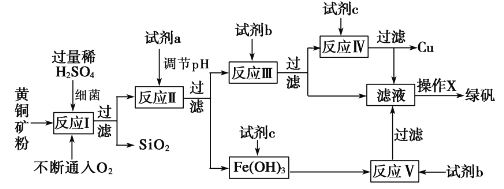
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表。
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
下列说法不正确的是
A. 试剂a可以是CuO或Cu(OH)2,作用是调节pH至3.7~4.7之间
B. 反应I的化学反应方程式为4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,该反应中铁元素被还原
C. 操作X为蒸发浓缩至溶液表面出现晶膜,再冷却结晶
D. 反应Ⅲ的离子方程式为Cu2++Fe==Cu+Fe2+,试剂c参与反应的离子方程式分别为Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O