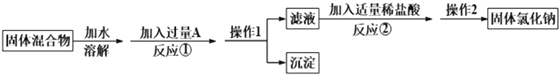
题目内容
【题目】铅是一种高密度、柔软的蓝灰色金属。2019年7月23日,铅被列入有害水污染物名录。请回答下列问题。
(1)Pb位于第六周期,与C元素同族。请写出它的外围电子排布式___________,对比以下三种氧化物的熔沸点![]() 、
、![]() 、
、![]() ,从小到大分别为_____________,请解释原因:____________________。
,从小到大分别为_____________,请解释原因:____________________。
(2)铅在自然界主要以方铅矿(PbS)及白铅矿(![]() )的形式存在,也存在于铅矾(
)的形式存在,也存在于铅矾(![]() )中。
)中。![]() 中心原子轨道的杂化类型___________,
中心原子轨道的杂化类型___________,![]() 的空间构型____________。
的空间构型____________。
(3)四乙基铅[![]() ]曾广泛用作汽油中的抗爆剂,由Pb提供空轨道,有机原子团提供孤电子对形成,该化合物中存在化学键类型有_____________
]曾广泛用作汽油中的抗爆剂,由Pb提供空轨道,有机原子团提供孤电子对形成,该化合物中存在化学键类型有_____________
A.金属键 B.离子键 C.共价键 D.配位键
(4)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(![]() )半导体作为吸光材料,
)半导体作为吸光材料,![]() 具有钙钛矿(
具有钙钛矿(![]() )的立方结构,其晶胞如图所示:
)的立方结构,其晶胞如图所示:
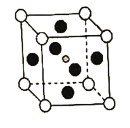
①比较元素电负性:C_________N(填“>”或“<”),比较基态原子第一电离能:C________Pb(填“>”或“<”)
②![]() 晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M在晶胞中处于_____________位置,X在晶胞中处于________位置。
晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M在晶胞中处于_____________位置,X在晶胞中处于________位置。
③![]() 晶体的晶胞边长为a nm,其晶体密度为d
晶体的晶胞边长为a nm,其晶体密度为d![]() ,则阿伏加德罗常数的值NA的计算表达式为_____________
,则阿伏加德罗常数的值NA的计算表达式为_____________
【答案】![]()
![]()
![]() 是分子晶体,
是分子晶体,![]() 是离子晶体,
是离子晶体,![]() 是原子晶体
是原子晶体 ![]() 正四面体 CD < > 体心 面心
正四面体 CD < > 体心 面心 ![]()
【解析】
由Pb在周期表的位置写出它的外围电子排布式,根据SiO2、PbO2、CO2晶体类型判断熔沸点高低,根据元素周期律判断电负性及第一电离能的大小,由密度d=![]() ,求出NA即可。
,求出NA即可。
(1)Pb与C元素同族,最外层电子数为4,位于第六周期,则它的外围电子排布式为6s26p2;因为SiO2是原子晶体,熔沸点很高,PbO2是离子晶体,熔沸点较高,CO2是分子晶体,熔沸点较低,所以三种氧化物的熔沸点从小到大分别为CO2<PbO2<SiO2;答案为6s26p2,CO2<PbO2<SiO2;SiO2是原子晶体,PbO2是离子晶体,CO2是分子晶体。
(2)CO32-中心原子没有孤电子对,σ键电子对数为3,中心原子的价层电子对数为3,则轨道的杂化类型是sp2;SO42-中心原子为sp3杂化,则SO42-的空间构型为正四面体;答案为sp2,正四面体。
(3)四乙基铅[(CH3CH2)4Pb]中由Pb提供空轨道,有机原子团提供孤电子对形成配位键,乙基中碳原子和碳原子之间、碳原子和氢原子之间形成共价键;答案为CD。
(4)①C、N属于同周期,同周期从左向右,电负性逐渐增大,则电负性C<N;同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小,所以第一电离能大小顺序C>Pb;答案为<,>。
②本题属于立方晶胞,AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则卤素阴离子必然位于立方体的6个面的面心,正好构成正八面体;M位于八面体的体心,也是立方体的体心;答案为体心,面心。
③晶体体积V=(a×10-7)3cm3,晶体密度d= ![]() g/cm3,则NA=
g/cm3,则NA=![]() =
=![]() ;答案为
;答案为![]() 。
。

【题目】由下列实验及现象,推出的相应结论正确的是
实验 | 现象 | 结论 |
A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧 | 火焰呈黄色 | 此盐溶液中含有 Na+,不含 K+ |
B.向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C.将足量SO2气体通入石蕊试液中 | 石蕊试液变红色 | SO2水溶液显酸性 |
D.向酸性KMnO4溶液中通入SO2 | 溶液紫色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D