题目内容
【题目】(1)已知:① C(s) + O2(g)=CO2(g) H=-393.5 kJmol-1
②2CO(g) + O2(g)=2CO2(g) H=-566 kJmol-1
③TiO2(s) + 2Cl2(g)=TiCl4(s) + O2(g) H=+141 kJmol-1
则TiO2(s) + 2Cl2(g) + 2C(s)=TiCl4(s) + 2CO(g)的H=_________________。
(2)氯化银在水中存在沉淀溶解平衡AgCl(s)![]() Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
(3)20 ℃时,0.1 molL-1 NH4Al(SO4)2溶液的pH=3,则:2c(SO42-)-c(NH4+)-3c(Al3+)≈______________molL-1(填数值)。
【答案】-80 kJmol-1 6×10-10 10-3
【解析】
(1)根据盖斯定律计算;
(2) 0.1 molL-1氯化铝溶液中,c(Cl-)=0.3mol/L,利用c(Ag+)= 计算;
计算;
(3)根据溶液呈电中性判断。
(1)根据盖斯定律,③+2×①-②,可得TiO2(s) + 2Cl2(g) + 2C(s)=TiCl4(s) + 2CO(g),H=+141+2×(-393.5)+ 566=-80 kJmol-1;
(2) 0.1 molL-1氯化铝溶液中,c(Cl-)=0.3mol/L,25℃时,氯化银的Ksp=1.8×10-10,则c(Ag+)= =6×10-10mol/L;
=6×10-10mol/L;
(3)根据溶液呈电中性可知,3c(Al3+)+ c(H+)+ c(NH4+)=2c(SO42-)+ c(OH-),2c(SO42-)-c(NH4+)-3c(Al3+)= c(H+)- c(OH-)=10-3-10-11≈10-3mol/L。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
①2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_____。
a 若混合气体密度保持不变,则已达平衡状态
b 达平衡后若再充人一定量CO2,平衡常数保持不变
c 分离出部分S,正、逆反应速率均保持不变,平衡不移动
d 从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通人2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
(2)利用CO、H2可制备天然气,主要反应为:
CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
回答下列问题:
①反应CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
②在恒压管道反应器中按n(H2):n(CO) = 3:1通入原料气,在催化剂作用下制备合成天然气,400 ℃ p总为100 kPa时反应体系平衡组成如下表所示:
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
则该条件下CO的总转化率α=____。![]()
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I :CH4(g) ![]() C(s) + 2H2(g) H = +75 kJ·mol-1;
C(s) + 2H2(g) H = +75 kJ·mol-1;
反应Ⅱ:2CO(g) ![]() C(s) + CO2(g) H = -172 kJ·mol-1,
C(s) + CO2(g) H = -172 kJ·mol-1,
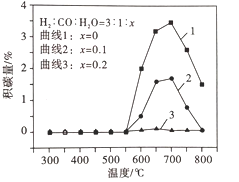
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是__。
A 曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B 曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C 曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D 水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳