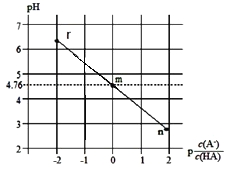
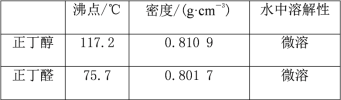题目内容
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂,它能将工厂排放的CO)以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充有Na2CO3溶液,其原理如图所示。
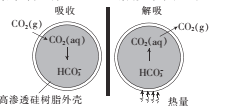
(1)这种微胶囊吸收CO2的原理是 ____用离子方程式表示),此过程是_____填“吸收”或“放出”)能量的过程。
(2)在吸收过程中下列关于胶囊内溶液的说法正确的是 ___(填字母)。
a.吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b.吸收过程中,体系中的含碳微粒只有CO32-、HCO3-、H2CO3
c.当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d.溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将解吸后的CO2催化加氢可制取乙烯。
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1
2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H3=_______________
(4)在体积为2L的恒容容器中发生反应:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)。当投料为1 mol CO2(g)和3molH2 (g)时,测得温度对CO2平衡转化率的影响为曲线a,改变投料比![]() 测量后得到曲线b。
测量后得到曲线b。
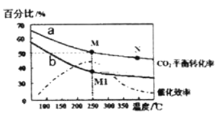
①根据曲线a计算250℃时该反应的化学平衡常数K= ____代入数值列出计算式即可)。
②b条件下投料比![]() ____(填“>” “<”或“=”)3,判断依据是 __ 。
____(填“>” “<”或“=”)3,判断依据是 __ 。
③下列说法正确的是 ___(填字母)。
A.平衡常数大小:M>N>M1
B.其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
C.当压强、混合气体的密度或![]() 不变时均可视为化学反应已达到平衡状态
不变时均可视为化学反应已达到平衡状态
D.工业生产中采取较高温度(250℃左右)是为了提高催化剂活性加快反应速率
【答案】CO2+CO32-+H2O=2HCO3- 放出 cd -127.8kJ·mol-1 ![]() < 其他条件不变时,减少氢气的浓度,可以减少CO2的转化率 D
< 其他条件不变时,减少氢气的浓度,可以减少CO2的转化率 D
【解析】
(1)根据CO2与CO32-反应进行分析,根据图像解吸是吸收过程;
(2)根据盐类水解,结合物料守恒和电荷守恒进行判断;
(3)利用盖斯定律进行分析和计算;
(4)①利用“三段式”方法进行分析计算;
②根据图像,b曲线CO2平衡转化率比曲线a低,其他条件不变,增大H2的量,CO2的转化率增大,据此分析;
③根据图像可以得到催化效率随温度变化进行分析;
(1)胶囊内部充有Na2CO3溶液,通入CO2发生CO2+CO32-+H2O=2HCO3-;根据图可知解吸过程为吸热过程,则吸收CO2过程为放出能量的过程;
(2)a.吸收前溶液为Na2CO3,Na2CO3为强碱弱酸盐,CO32-发生水解,溶液显碱性,离子浓度大小顺序是c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)> c(H+),故a错误;
b.根据图,可知吸收CO2时,溶液中溶解了部分CO2,所以吸收过程中,体系中的含碳微粒除了CO32-、HCO3-、H2CO3外,还有CO2分子,故b错误;
c.当n(CO2):n(Na2CO3)=1:3,发生的反应有CO2+CO32-+H2O=2HCO3-,1molCO2能消耗1molCO32-,生成2molHCO3-,生成HCO3-的物质的量等于剩余CO32-的物质的量,但CO32-水解程度大于HCO3-水解,因此c(HCO3-)>c(CO32-),故c正确;
d.根据电荷守恒,溶液中始终有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故d正确;
故答案选cd;
(3)①C2H4(g)+3O2(g)=2CO2(g)+2H2O(g),②2H2(g)+O2(g)=2H2O(g),根据目标反应方程式,因此有3×②-①,得出△H3=3×△H2-△H1=[3×(-483.6)-(-1323)]kJ·mol-1=-127.8kJ·mol-1;
(4)①250℃时,CO2的转化率为50%,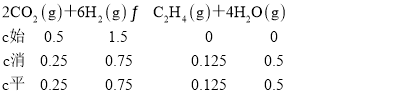 ,化学平衡常数K=
,化学平衡常数K=![]() =
=![]() ;
;
②由曲线b可知,M1点CO2的平衡转化率小于50%,说明反应逆向移动,其他条件不变时,减小n(H2)可使反应逆向移动,CO2的平衡转化率降低,所以![]() <3;
<3;
③A.平衡常数只受温度的影响,M和M1的温度相同,则化学平衡常数:M=M1,该反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减少,即M1>N,从而得出M=M1>N;故A错误;
B.加入催化剂,反应速率加快,但平衡不移动,故B错误;
C.恒容状态下,反应物生成物均为气体,气体质量不变,容器的体积不变,密度恒为定值,不能作为是否达到平衡的判断依据,故C错误;
D.由图可知,催化剂催化效率随温度升高先增大后降低,温度为250℃左右时,催化效率最高,则工业生产中采取较高温度是为了提高催化剂活性加快反应速率,故D正确。
故答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4 ①
R-OH+HBr![]() R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答:
(1)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是___(填字母)。
a.分液 b.蒸馏 c.萃取 d.过滤
(2)溴乙烷的水溶性___乙醇(填“大于”、“等于”或“小于”),其原因是___。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在___(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是___(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)为了检验溴乙烷中含有溴元素,通常采用的方法是:取少量溴乙烷,然后进行下列操作:①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液。下列操作顺序合理的是___(填字母)。
a.①②③④ b.②③①④ c.④①③② d. ①④②③
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___。
【题目】1L某混合溶液,只可能含有下表中的若干种离子:
可能大量含有的阳离子 |
|
可能大量含有的阴离子 |
|
当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是![]()
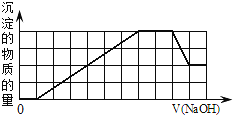
A.原溶液中加入盐酸有沉淀生成
B.原溶液中一定含有![]() 和
和![]()
C.反应最后得到的沉淀只有![]()
D.反应最后形成的溶液中溶质只有![]()