��Ŀ����
����Ŀ�������̿��ĩ����Ҫ�ɷ�MnO2��������Al2O3��Fe2O3�����ʣ�Ϊԭ����MnSO4��H2O�Ĺ����������£�
��֪��pH��3.3����Һ������Fe3+��pH��5.0����Һ������Al3+��pH��8��Mn2+��ʼ������
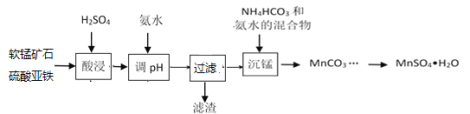
��1�����������������䣬�ڲ�ͬ�¶��¶Ժ����̿�۽���������̽�������ʱ��仯��ͼ�����������¶���ʱ��ֱ�Ϊ________�桢______min��
��2���������ʱ���ὫFe2+������Fe3+���������ķ�Ӧ���ӷ���ʽΪ__________��
��3�����ʱҪ�������ᣬ����Ũ�Ȳ��ܹ�����߹�С��������Ũ�ȹ�Сʱ��������к��ɫ�������֣�ԭ����_____________________________��
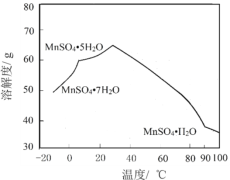
��4��MnSO4��ˮ�е��ܽ�����¶ȹ�ϵ��ͼ����MnCO3��ýϴ�����MnSO4H2O����ķ����ǣ���MnCO3����_________�������¶�Ϊ_________���Ͻᾧ���õ�MnSO4H2O���壬ϴ�ӡ���ɡ�
���𰸡�70�� 120min ���ɵ�Fe3+ˮ��õ�Fe(OH)3���� 2Fe2+��MnO2��4H+��2Fe3+��Mn2+��2H2O ������ϡ���� 90��
��������
(1)����ͼ���֪��ʱ����120minʱ���¶���70���90��ʱ�����ʴﵽ90%��
(2)�������ʱ���������������������½�Fe2+������Fe3+��
(3)������Ũ�ȹ�Сʱ����Һ�е�������������������������
(4)����ͼ������жϡ�
(1)����ͼ���֪��ʱ����120minʱ���¶���70���90��ʱ�����ʴﵽ90%��������¶�Ϊ70�棬ʱ��Ϊ120min��
(2)�������ʱ���������������������½�Fe2+������Fe3+�������ӷ���ʽΪ2Fe2+��MnO2��4H+��2Fe3+��Mn2+��2H2O��
(3)������Ũ�ȹ�Сʱ����Һ�е�������������������������
(4)��̼������ȡMnSO4H2O����MnCO3����������ϡ���ᣬ����ͼ������¶���90�����ϡ�

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�����Ŀ��1Lij�����Һ��ֻ���ܺ����±��е����������ӣ�
���ܴ������е������� |
|
���ܴ������е������� |
|
�������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ����ͼ��ʾ������˵����ȷ����![]()
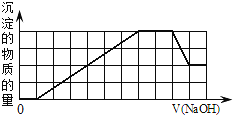
A.ԭ��Һ�м��������г�������
B.ԭ��Һ��һ������![]() ��
��![]()
C.��Ӧ���õ��ij���ֻ��![]()
D.��Ӧ����γɵ���Һ������ֻ��![]()
����Ŀ���±���25��ʱ����ĵ���ƽ�ⳣ��������˵����ȷ����
CH3COOH | HClO | H2CO3 |
Ka=1.8��10��5 | Ka=3.0��10��8 | Ka1=4.1��10��7 Ka2=5.6��10��11 |
A.���ݱ������ݿ�֪����ͬŨ��CH3COONa��NaClO�Ļ����Һ�У���������Ũ�ȵĴ�С��ϵ�ǣ�c(Na+)��c(ClO��)��c(CH3COO��)��c(OH��)��c(H+)
B.���ݱ������ݿ�֪������������Һ��ͨ������CO2�����ӷ���ʽΪ��2ClO��+CO2+H2O=CO32��+2HClO
C.��0.1mol��L-1CH3COOH��Һ�м�������ˮ����Һ��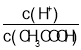 ��С
��С
D.�����£���̼������Һ������70������Һ���е�OH����Ŀ����
����Ŀ������ȩ������ˮ���������л��ܼ����ܶ�Լ����ˮ���ܶȣ��ڼ��������·����绯��Ӧ�����Ʊ�������ͱ��״�����ˮ���ܽ�Ȳ����������л��ܼ����ܶ�Լ����ˮ���ܶȣ�����Ӧԭ�����£�
2C6H5CHO+NaOH��C6H5CH2OH+C6H5COONa
C6H5COONa+HCl��C6H5COOH+NaCl
��������������������
����ȩ | ���״� | ������. | �� | |
�е�/�� | 178 | 205 | 249 | 80 |
�۵�/�� | 26 | -15 | 122 | 5.5 |
��������ˮ�е��ܽ� | ||
17�� | 25�� | 100�� |
0.21g | 0.34g | 5.9g |
ʵ���������£�

��1������������������1Сʱ����ͼ1�������м��ȹ̶�װ��δ������

����A������Ϊ___����������B��Ϊͼ2�е�����C��Ч������B����˵��ԭ��___��
��2���������йط�Һ©����ʹ�ò���ȷ����___������ĸ����
A.��Һ©����ʹ��֮ǰ�������Ƿ�©ˮ
B.��Һ©���ڵ�Һ�岻�ܹ��࣬����������
C.�����Һ©����������̨�Ͼ��ã��ֲ���������������з�Һ
D.��Һʱ���²�Һ�����������ر���������һ���ձ��ٴ�����ʹ�ϲ�Һ������
��3�����������÷�ˮԡ���������ٽ��в����ܣ���ͼ2�����ռ�___�����֡�ͼ2����һ�����Դ�����ȷ��Ӧ��Ϊ___��
��4������ʱ����ͼ3���ձ��б����ᾧ��ת�벼��©��ʱ�������ϻ�ճ���������壻��___��ϴ�����ϲ����ľ��塣������ɺ���������ˮ�Ծ������ϴ�ӣ�ϴ��ǰӦ��___��
��5���õ�����ƽȷ��ȡ0.2440g����������ƿ�м�100mL����ˮ�ܽ⣨��Ҫʱ���Լ��ȣ�������0.1000mol��L-1�ı�����������Һ�ζ��������ı�����������Һ19.20mL��������Ĵ���Ϊ___%��
