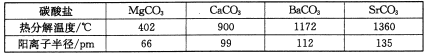
题目内容
【题目】某盐R的化学工为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液各5 mL进行如下实验:
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲4.66g,且甲不溶于稀盐酸。
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.224L(标准状况),乙能使湿润的红色石蕊试纸变蓝。
据此回答:
(1)写出R和甲的化学式:R ;甲 。
(2)另取500mL R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示。则:
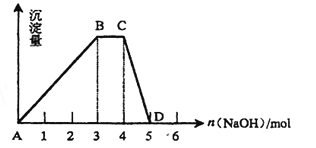
①R溶液的物质的量浓度为 。
②BC段表示的含义是 。
③CD段表示的含义是 。
【答案】(1)NH4Al(SO4)2 BaSO4 (2)2mol/L
NH4+与OH—生成NH3·H2O Al(OH)3与NaOH反应,沉淀逐渐溶解
【解析】
试题分析:(1)R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,说明含有铝离子,最终剩余沉淀甲4.66g为硫酸钡沉淀,因此含有硫酸根离子;B取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.224L(标准状况),乙能使湿润的红色石蕊试纸变蓝,因此乙是氨气,则R中含铵根离子;因此R为:NH4Al(SO4)2;
(2)从图象可看出,沉淀达到最大量耗氢氧化钠3mol,根据反应Al3++3OH-═Al(OH)3↓可知铝离子物质的量为1mol,所以R的物质的量为1mol,R的物质的量浓度为:![]() =2mol/L;铵根离子和碱反应生成一水合氨,故沉淀无变化;CD段为氢氧化铝溶解的反应,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O。
=2mol/L;铵根离子和碱反应生成一水合氨,故沉淀无变化;CD段为氢氧化铝溶解的反应,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O。

【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:
。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。