题目内容
【题目】【化学一选修3:物质结构与性质】 碳是地球上组成生命的最基本元素之一,可以sp3 、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有 种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
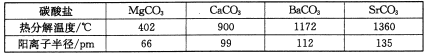
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
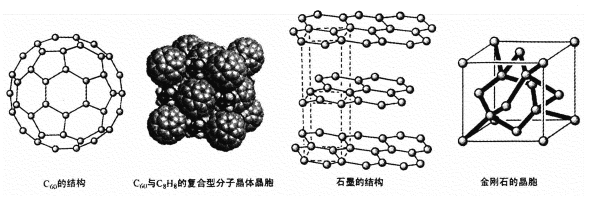
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为 cm。
(6)碳的第三种同素异形体—一金刚石,其晶胞如上图所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如下图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图 (从A~D图中选填)。
【答案】(1)6;![]() ;(2)平面三角形;sp2;(3)因为碳酸盐的分解过程实际上是晶体中阳离子结合CO32-中的氧离子,使CO32-分解为CO2的过程,所以当阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力就越强,对应的碳酸盐就越容易分解;(4)C8H8·C60或者C60·C8H8;(5)4;
;(2)平面三角形;sp2;(3)因为碳酸盐的分解过程实际上是晶体中阳离子结合CO32-中的氧离子,使CO32-分解为CO2的过程,所以当阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力就越强,对应的碳酸盐就越容易分解;(4)C8H8·C60或者C60·C8H8;(5)4;![]() ;(6)D
;(6)D
【解析】
试题分析:(1)基态碳原子核外有6个电子,根据泡利原理,在同一基态原子中,不可能有运动状态完全相同的电子,所以基态碳原子有6种空间运动状态的电子,其价电子为2s22p2,排布图为:![]() ;答案为:6
;答案为:6 ![]() ;(2)光气分子中,C原子上的б电子对为3对,孤电子对=
;(2)光气分子中,C原子上的б电子对为3对,孤电子对=![]() ,C原子上的价电子对数为三,VSEPR模型为平面三角形,没有孤电子,所以分子空间构型为:平面三角形,碳的杂化方式为sp2杂化,答案为:平面三角形;sp2;(3),从表中可以看出阳离子电荷相同时,阳离子半径越大,其分解温度越高,主要原因是碳酸盐的分解过程实际上是晶体中阳离子结合CO32-中的氧离子,使CO32-分解为CO2的过程,所以当阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力就越强,对应的碳酸盐就越容易分解;(4)C60分子晶胞的空间构型为分子密堆积,所以每一个C60晶体的分子间空隙中可以填充一个立方烷,所以该复合型分子晶体中立方烷和C60的个数比为:1:1,所以该复合型分子晶体的组成用二者的分子式可表示为C8H8·C60或者C60·C8H8,答案为:C8H8·C60或者C60·C8H8;(5)石墨晶胞中含碳原子的个数为:
,C原子上的价电子对数为三,VSEPR模型为平面三角形,没有孤电子,所以分子空间构型为:平面三角形,碳的杂化方式为sp2杂化,答案为:平面三角形;sp2;(3),从表中可以看出阳离子电荷相同时,阳离子半径越大,其分解温度越高,主要原因是碳酸盐的分解过程实际上是晶体中阳离子结合CO32-中的氧离子,使CO32-分解为CO2的过程,所以当阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力就越强,对应的碳酸盐就越容易分解;(4)C60分子晶胞的空间构型为分子密堆积,所以每一个C60晶体的分子间空隙中可以填充一个立方烷,所以该复合型分子晶体中立方烷和C60的个数比为:1:1,所以该复合型分子晶体的组成用二者的分子式可表示为C8H8·C60或者C60·C8H8,答案为:C8H8·C60或者C60·C8H8;(5)石墨晶胞中含碳原子的个数为:![]() ,所以石墨晶胞中含碳原子个数为4,石墨晶体的层间距为:
,所以石墨晶胞中含碳原子个数为4,石墨晶体的层间距为:
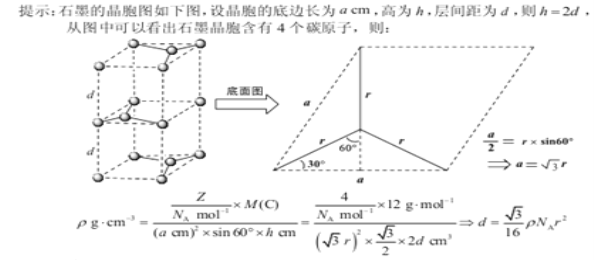
答案为:4;![]() ;
;

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案