题目内容
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点 (填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
【答案】(1)1s22s22p63s23p63d84s2或[Ar] 3d84s2 2
(2)①正四面体
②配位键 N
③高于 NH3分子间可形成氢键 极性 sp3
(3)金属 铜失去的是全充满的3d10电子,镍失去的是4s1电子
(4)①3:1
②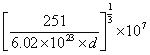
【解析】
试题分析:(1)镍是28号元素,位于第四周期,第Ⅷ族,根据核外电子排布规则,其基态原子的电子排布式为1s22s2 2p63s23p63d84s2,3d能级有5个轨道,这5个轨道先占满5个自旋方向相同的电子,再分别占据三个轨道,电子自旋方向相反,所以未成对的电子数为2。
(2)①根据价层电子对互斥理论,SO42-的σ键电子对数等于4,孤电子对数(6+2-2×4)÷2=0,则阴离子的立体构型是正四面体形。
②根据配位键的特点,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是N。
③氨气分子间存在氢键,分子间作用力强,所以氨的沸点高于膦(PH3);根据价层电子对互斥理论,氨气中心原子N的σ键电子对数等于3,孤电子对数(5-3)÷2=1,则中心原子N是sp3杂化,分子成三角锥形,正负电荷重心不重叠,氨气是极性分子。
(3)铜和镍属于金属,所以单质铜及镍都是由金属键形成的晶体;铜和镍分别失去一个电子后若再失去电子,铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以ICu>INi。
(4)①根据均摊法计算,晶胞中铜原子个数为6×1/2=3,镍原子的个数为8×1/8=1,则铜和镍的数量比为3:1。
②根据上述分析,该晶胞的组成为Cu3Ni,合金的密度为dg/cm3,根据p=m÷V=251÷[(a3×NA)]=d,1cm=107nm,则晶胞参数a=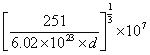 nm。
nm。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案