题目内容
12.下列说法正确的是( )| A. | 凡金属跟非金属元素化合时都能形成离子键 | |
| B. | 离子化合物熔融状态下一定导电 | |
| C. | 离子化合物中的阳离子只能是金属离子,酸根离子中不能含有金属元素 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
分析 A.金属元素和非金属元素之间可能形成共价键;
B.离子化合物在熔融状态下能电离出自由移动的离子;
C.离子化合物中阳离子可能不是金属离子,酸根离子中可能含有金属元素;
D.溶于水可以导电的化合物可能是共价化合物.
解答 解:A.金属元素和非金属元素之间可能形成共价键,如氯化铝,故A错误;
B.离子化合物在熔融状态下能电离出自由移动的离子,含有自由移动离子或电子的物质能导电,所以熔融状态下的离子化合物一定能导电,故B正确;
C.离子化合物中阳离子可能不是金属离子,如铵根离子,酸根离子中可能含有金属元素,如AlO2-,故C错误;
D.溶于水可以导电的化合物可能是共价化合物,如硫酸等,故D错误;
故选B.
点评 本题考查物质与化学键的关系,明确物质的构成及构成微粒之间作用力即可解答,注意采用举例法分析解答,注意规律中的反常现象,易错选项是A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.除去Na2CO3溶液中少量NaHCO3杂质的方法是( )
| A. | 加入适量NaOH溶液 | B. | 加入适量盐酸 | ||
| C. | 加热 | D. | 通入CO2气体 |
20.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30g二氧化硅晶体中含有Si-O键数目为2NA | |
| B. | 标准状况下,2.24L CHCl3的原子总数为0.1NA | |
| C. | 一定条件下,将1molN2与3molH2混合反应后,生成NH3分子的数目为2NA | |
| D. | 常温下,0.1mol/LNH4NO3溶液NO${\;}_{3}^{-}$的数目为0.1NA |
7.下列分子式表示的物质一定是纯净物的是( )
| A. | C5H10 | B. | C2H6O | C. | CH2Cl2 | D. | C2H4Cl2 |
17.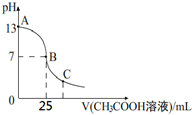 25℃时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示.下列有关混合溶液说法错误的是( )
25℃时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示.下列有关混合溶液说法错误的是( )
 25℃时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示.下列有关混合溶液说法错误的是( )
25℃时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示.下列有关混合溶液说法错误的是( )| A. | A、B间的溶液中可能有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | B点:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) | |
| C. | C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | NaOH溶液和醋酸溶液的浓度都恰好为0.1 mol•L-1 |
1.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 23g钠与足量氧气充分反应,转移的电子个数为NA | |
| B. | 将1molFeCl3水解制成胶体,所得胶体的微粒数为NA | |
| C. | 1mol Na2O2与水完全反应时转移电子数为2NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
2.莫尔盐常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-) |
 .
.