题目内容
4.氯化铍是用于制有机铍化合物和金属铍的重要原料.(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为2s2,其元素的第一电离能>B元素(填“>”或“<”或“=”),原因是Be的2s轨道全充满,体系能量低.
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为分子晶体; BeCl2中Be原子的杂化轨道类型是sp.
(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是共价键、配位键,阴离子的结构式为
 .
.
分析 (1)根据核外电子排布规律书写Be原子的基态价电子排布式;Be的2s轨道为全充满稳定状态;
(2)根据晶体的性质判断晶体类型;BeCl2中Be原子的杂化轨道数为2;
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构.
解答 解:(1)Be原子的电子排布式为1s22s2,Be原子的基态价电子排布式为2s2.Be的2s轨道为全充满,稳定状态,体系能量低,第一电离能高于同周期相邻元素,
故答案为:2s2;>;Be的2s轨道全充满,体系能量低;
(2)BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为分子晶体;BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取 sp 杂化方式,
故答案为:分子晶体; sp;
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,结构式为 ,故答案为:共价键、配位键;
,故答案为:共价键、配位键; .
.
点评 本题考查核外电子排布规律、元素周期律、晶体结构与化学键等,难度不大,注意基础知识的掌握.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.不粘锅是在普通锅的内侧涂覆上一层树脂而成,这层树脂的主要成分是聚四氟乙烯.洗衣店干洗西装是用有机溶剂来洗衣服的,目前使用的标准干洗剂的主要成分是四氯乙烯.关于聚四氟乙烯和四氯乙烯,下面的说法正确的是( )
| A. | 它们都是乙烯的同系物 | B. | 它们都属于混合物 | ||
| C. | 它们的分子中都含有C=C双键 | D. | 它们分子中都不含氢原子 |
12.下列说法正确的是( )
| A. | 凡金属跟非金属元素化合时都能形成离子键 | |
| B. | 离子化合物熔融状态下一定导电 | |
| C. | 离子化合物中的阳离子只能是金属离子,酸根离子中不能含有金属元素 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
19. 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解.冷却至室温.(已知室温条件下氯化钠溶解度为36g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、石棉网、烧杯和玻璃棒.冷却至室温过程中若出现固体析出(填现象),则证明其为饱和溶液.
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加乳入0.1mol/L稀硫酸,振荡,溶液变为蓝色.该实验发生的化学反应中氧化剂与还原剂的物质的量之比为1:5.请在图中画出参加反应的IO3-的物质的量和析出的I2单质的物质的量的关系曲线.
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝.反应的离子方程式为:O2+4I-+4H+=2I2+2H2O.请你设计实验方案验证乙同学的假设是否正确:向1mol/L的KI溶液中加入0.1mol/L稀硫酸和几滴淀粉溶液,振荡,若溶液变为蓝色,则乙同学的假设正确.
 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
(1)首先取该食盐样品配制室温下的饱和溶液:向200mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解.冷却至室温.(已知室温条件下氯化钠溶解度为36g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、石棉网、烧杯和玻璃棒.冷却至室温过程中若出现固体析出(填现象),则证明其为饱和溶液.
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加乳入0.1mol/L稀硫酸,振荡,溶液变为蓝色.该实验发生的化学反应中氧化剂与还原剂的物质的量之比为1:5.请在图中画出参加反应的IO3-的物质的量和析出的I2单质的物质的量的关系曲线.
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝.反应的离子方程式为:O2+4I-+4H+=2I2+2H2O.请你设计实验方案验证乙同学的假设是否正确:向1mol/L的KI溶液中加入0.1mol/L稀硫酸和几滴淀粉溶液,振荡,若溶液变为蓝色,则乙同学的假设正确.
9.下面几组物质,请将合适组号填写在下表中.
①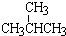 和
和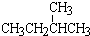 ; ②
; ②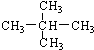 和
和 ; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
①
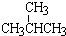 和
和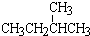 ; ②
; ②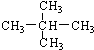 和
和 ; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 | ⑤⑥ | ①③ | ④⑧ | ②⑦ |
13.人的血液里Ca2+的浓度一般采用g•cm-3表示,今抽一血样20.00mL加入适量的草酸铵[(NH4)2C2O4]溶液,可析出CaC2O4沉淀,将沉淀洗净后溶于强酸可得草酸,再用浓度为0.02mol•L-1的KMnO4溶液滴定.当观察到溶液紫色褪尽时,共消耗12.00mL KMnO4溶液.则该血液样品中Ca2+的浓度为( )
| A. | 0.0015 g•cm-3 | B. | 0.0012 g•cm-3 | C. | 0.0024 g•cm-3 | D. | 0.002 g•cm-3 |
14.关于下列各图的叙述,正确的是( )
| A. | 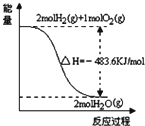 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为-241.8kJ•mol-1 | |
| B. | 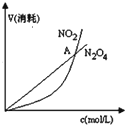 表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 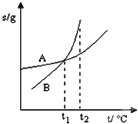 表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 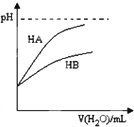 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化.则NaA溶液的pH小于等物质的量浓度的NaB溶液的pH |
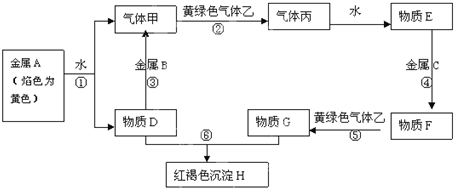
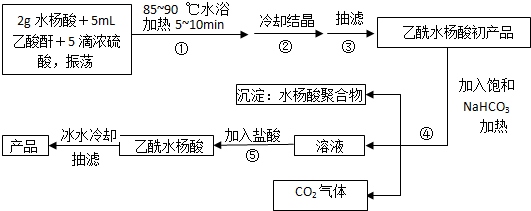
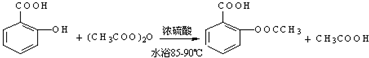 ;反应类型取代反应;
;反应类型取代反应; 、
、 ;
; ;
;